Quantifizierung pharmakodynamischer Biomarker: Arzneimittelwirkung und Bioanalyse bei der Entwicklung neuer chemischer Einheiten
11. Januar 2024
Startseite > Veeda-Einblicke > Datenintegrität in der klinischen Forschung

Die wissenschaftliche Gemeinschaft war Zeuge einiger der schlimmsten Tragödien in der Geschichte der Datenintegrität klinischer Studien. Von 2015 bis heute haben das Journal of the American Medical Association (JAMA) und die Zeitschriften des JAMA Network mindestens 18 Mitteilungen veröffentlicht, in denen Bedenken hinsichtlich Datenfehlern und/oder Datenfälschungen geäußert wurden.
1 Beispielsweise wurden die von einem japanischen Anästhesisten und Forscher durchgeführten Studien zur Behandlung von postoperativer Übelkeit und Erbrechen im Jahr 2012 von der japanischen Gesellschaft für Anästhesisten (JSA) überprüft und überraschende Erkenntnisse gewonnen.
Die aus den Studien gewonnenen Daten waren entweder völlig gefälscht oder gefälscht, und etwa 210 vom Anästhesisten veröffentlichte Veröffentlichungen enthielten gefälschte Daten.
2 Fehler in der Datenintegrität führten zu erheblichen Umsatzeinbußen, wobei die direkten Kosten auf etwa 525,000 US-Dollar geschätzt wurden, während die indirekten Kosten sich auf etwa 1.3 Millionen US-Dollar beliefen.3
Ein solches wissenschaftliches Fehlverhalten diente als Weckruf für strengere Vorschriften und Gesetze zur Überwachung der Arzneimittelentwicklung und des Arzneimittelkonsums.
Wissenschaftler erkannten die Notwendigkeit der Datenintegrität in jeder Phase zum Schutz menschlicher Subjekte an vorklinische Entwicklung zur Pharmakovigilanz.
Unter Datenintegrität versteht man papierbasierte oder elektronische Daten, die während ihres gesamten Lebenszyklus vom Zeitpunkt der Datenerstellung über die Archivierung, das Scannen, die Aufbewahrung bis hin zur Vernichtung vollständig, genau, konsistent und zuverlässig sind.
4 Die aktualisierte Richtlinie des International Council for Harmonization for Good Clinical Practice (ICH GCP E6[R2]) bekräftigt die Notwendigkeit der Datenintegrität sowie die Bedeutung der Überwachung klinischer Daten während der gesamten Studie.
Die US-amerikanische Food and Drug Administration (FDA) verwendet das Akronym ALCOA, um Erwartungen in Bezug auf die Datenintegrität zu definieren.4
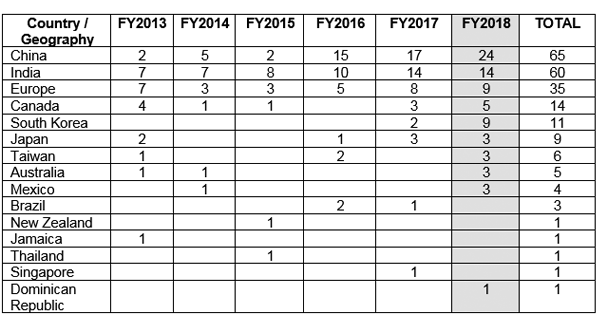
Die FDA hat an verschiedene Länder außerhalb der Vereinigten Staaten (USA) Warnschreiben zu guten Herstellungspraktiken (GMP) herausgegeben, in denen sie Compliance-Probleme bei der Datenintegrität anführte. Abbildung 1 zeigt, dass China die meisten GMP-Warnschreiben erhalten hat, gefolgt von Indien und Europa.5
Abbildung 1 Probleme mit GMP-Warnschreiben außerhalb der USA5
Die Datenintegrität kann überwacht werden, indem die folgenden Bereiche überprüft werden:6
SDV
Die strikte Einhaltung guter Dokumentationspraktiken (GDP) in den Aufzeichnungen klinischer Studien ist eine Möglichkeit, die Datenintegrität sicherzustellen. Das BIP sollte sowohl für Papierunterlagen als auch für elektronische Unterlagen und Unterschriften beachtet werden.
Ebenso wichtig ist die Notwendigkeit, wesentliche Dokumente aufzubewahren und zu organisieren, die vor Beginn einer klinischen Studie, während der Studie und nach Abschluss oder Beendigung einer Studie erforderlich sind.
Die Sammlung wesentlicher Dokumente, die am Standort des Sponsors und des Prüfers aufbewahrt wird, wird als Clinical Trial Master File (TMF) bezeichnet. TMF spielt eine wichtige Rolle bei der Erleichterung der Durchführung und Verwaltung von Studien und sorgt so für Datenintegrität und GCP-Konformität in allen Phasen der klinischen Studie. Das TMF ist das Dokument, das bei einem Audit oder einer Inspektion überprüft wird.8
Viele Pharmaunternehmen setzen inzwischen auf elektronisches TMF (e-TMF), um die Verwaltung großer und komplexer klinischer Studien, an denen zahlreiche Abteilungen oder CROs beteiligt sind, zu vereinfachen.
Datenzugriff und -kontrolle
Beim Umgang mit Daten aus klinischen Studien ist Vorsicht geboten. Die Vertraulichkeit der Daten sollte in allen Phasen einer klinischen Studie gewahrt bleiben, einschließlich der Zwischenergebnisse.
9 Die Möglichkeit, Daten zu manipulieren, etwa Daten zu verändern, zu löschen oder zu verfälschen, sollte durch eine klare Rollenabgrenzung eingeschränkt werden. Dies verhindert auch potenzielle Interessenkonflikte zwischen ähnlichen Rollen, die die Datenintegrität beeinträchtigen könnten.4
Das National Institute of Health (NIH) gibt an, dass nur stimmberechtigten Mitgliedern des Data and Safety Monitoring Board (DSMB) gestattet sein sollte, die Ergebnisse der Zwischenanalysen einzusehen, es sei denn, die Umstände machen eine Weitergabe von Daten erforderlich, beispielsweise im Falle schwerwiegender Nebenwirkungen Veranstaltungen.
9Darüber hinaus sollten die DMC-Mitglieder keinen Interessenkonflikt haben, der die Ergebnisdaten beeinflussen würde. Die FDA hat außerdem die Verwendung eines „unabhängigen Statistikers“-Modells zur Analyse von Zwischendaten empfohlen, der vom Hauptforscher und Studiensponsor unabhängig ist und dem DMC unvoreingenommene Ergebnisse meldet.10
Data Monitoring
Es ist notwendig, ein unabhängiges Datenüberwachungskomitee (DMC) einzurichten, das der Sicherheit und den Interessen der eingeschriebenen Probanden Priorität einräumt und die Authentizität der Daten sowie die Durchführung klinischer Studien prüft.9
Überwachung vor Ort: wird durchgeführt, um eventuelle Abweichungen zwischen den Quelldaten und den eingegebenen Daten nachzuvollziehen. Es ist auch besonders nützlich zu sehen, ob das Personal vor Ort mit dem Studiendokument vertraut ist und ob das Personal die Verantwortung für die ethische und verantwortungsvolle Durchführung der Studie nachgewiesen hat.11
Zentralisierter risikobasierter Ansatz: ICH GCP E6(R2) betont die Notwendigkeit einer zentralisierten Überwachung, um die Anzahl der Studienbesuche durch den klinischen Monitor zu reduzieren und die Fernerkennung zuverlässiger und unzuverlässiger Daten durch Statistiker oder anderes Datenmanagementpersonal zu ermöglichen.4,11
Risikobasierte Überwachung: Das Sponsorunternehmen muss einen robusten Risikomanagementplan entwickeln, um Risiken für menschliche Probanden zu verhindern oder zu mindern, indem es die Durchführung der Studie überwacht und die Datenqualität an allen Teststandorten überwacht.11
Datenintegritätsaudits12
Um enorme finanzielle Auswirkungen und Geschäftsverluste zu vermeiden, sollten Sponsorunternehmen und CROs in jedem Schritt der klinischen Studie ausreichend Wert auf die Wahrung der Datenintegrität legen, um deren Vollständigkeit, Genauigkeit und Konsistenz zu gewährleisten.
Quellen
1. Bauchner H, Fontanarosa Phil B, Flanagin A et al. Wissenschaftliches Fehlverhalten und medizinische Fachzeitschriften. 2018;320(19):1985-1987 https://jamanetwork.com/journals/jama/fullarticle/2708590
2. George SL und Buyse M. Datenbetrug in klinischen Studien. Clin Investig (Lond). 2015; 5 (2): 161 – 173.
3. Michalek AM, Hutson AD, Wicher CP et al. Die Kosten und unterschätzten Folgen von Fehlverhalten in der Forschung: Eine Fallstudie. PLoS Med. 2018;7(8):e1000318. https://doi.org/10.1371/journal.pmed.1000318
4. Rutherford M. ICH E6(R2) und Datenintegrität: Vier Schlüsselprinzipien. Klinischer Forscher. 2018 April;32(4):doi:10.14524/CR-18-4021. https://acrpnet.org/2018/04/17/ich-e6r2-data-integrity-four-key-principles/
5. https://www.pharmaceuticalonline.com/doc/an-analysis-of-fda-fy-drug-gmp-warning-letters-0003 Zugriff am 26. April 2019
6. Moody LE und McMillan S. Aufrechterhaltung der Datenintegrität in randomisierten klinischen Studien. Nur Res. 2002 Mar-Apr;51(2):129-33. https://www.ncbi.nlm.nih.gov/pubmed/11984384
7. http://firstclinical.com/fda-gcp/?show=MonitoringvAuditing&search=compliance&type=&page=1 Zugriff am 26. April 2019
8. https://www.ema.europa.eu/en/documents/scientific-guideline/draft-guideline-good-clinical-practice-compliance-relation-trial-master-file-paper/electronic-content-management-archiving-audit-inspection-clinical-trials_en.pdf Zugriff am 26. April 2019
9. Fleming TR, Sharples K, McCall J et al. Wahrung der Vertraulichkeit vorläufiger Daten zur Verbesserung der Integrität und Glaubwürdigkeit der Studie. Klinische Studien. 2008;5(2):157-67. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2703711/
10. Ellenberg SS. Schutz der Teilnehmer an klinischen Studien und Schutz der Datenintegrität: Werden wir den Herausforderungen gerecht? PLoS Med. 2012 Jun;9(6):e1001234.
11 https://www.thefdagroup.com/thefdgroup-blog/conducting-data-integrity-audits-a-quick-guide Zugriff am 26.
Die in diesem Artikel enthaltenen Informationen dienen ausschließlich der allgemeinen Orientierung zu Themen, die für den persönlichen Gebrauch des Lesers von Interesse sind, der die volle Verantwortung für deren Verwendung übernimmt. Dementsprechend werden die Informationen in diesem Artikel mit der Maßgabe bereitgestellt, dass der/die Autor(en) und der/die Herausgeber hierin nicht mit der Erbringung professioneller Ratschläge oder Dienstleistungen befasst sind. Daher sollte es nicht als Ersatz für die Beratung durch einen kompetenten Berater dienen. Bevor der Leser eine Entscheidung trifft oder Maßnahmen ergreift, sollte er immer einen professionellen Berater zu Rate ziehen, der sich auf den betreffenden Artikelbeitrag bezieht.
Obwohl alle Anstrengungen unternommen wurden, um sicherzustellen, dass die in diesem Artikel enthaltenen Informationen aus zuverlässigen Quellen stammen, ist Veeda Clinical Research nicht für etwaige Fehler oder Auslassungen oder für die Ergebnisse verantwortlich, die sich aus der Verwendung dieser Informationen ergeben.
Alle Informationen in diesem Artikel werden „wie besehen“ bereitgestellt, ohne Gewähr für Vollständigkeit, Richtigkeit, Aktualität oder die durch die Verwendung dieser Informationen erzielten Ergebnisse und ohne Gewährleistung jeglicher Art, weder ausdrücklich noch stillschweigend, einschließlich, aber nicht beschränkt auf Garantien der Leistung, Marktgängigkeit und Eignung für einen bestimmten Zweck.
Nichts hierin ersetzt in irgendeiner Weise die unabhängigen Untersuchungen und das gesunde technische und geschäftliche Urteilsvermögen des Lesers. In keinem Fall haften Veeda Clinical Research oder seine Partner, Mitarbeiter oder Vertreter gegenüber dem Leser oder anderen Personen für Entscheidungen oder Maßnahmen, die im Vertrauen auf die Informationen in diesem Artikel getroffen werden, oder für Folgeschäden, besondere oder ähnliche Schäden , auch wenn auf die Möglichkeit solcher Schäden hingewiesen wurde.
Kein Teil dieser Veröffentlichung darf ohne die vorherige schriftliche Genehmigung des Herausgebers reproduziert, in einem Abrufsystem gespeichert oder in irgendeiner Form oder mit irgendwelchen Mitteln, sei es mechanisch, elektronisch, durch Fotokopieren, Aufzeichnen oder auf andere Weise, übertragen werden.
Für Informationen kontaktieren Sie uns unter:
Veeda Clinical Research Private Limited
Vedant Complex, neben dem YMCA Club, SG Highway,
Vejalpur, Ahmedabad – 380 051,
Gujarat Indien.
Telefon: + 91-79-3001-3000
Fax: + 91-(79) 3001-3010
Email: info@veedacr.com
