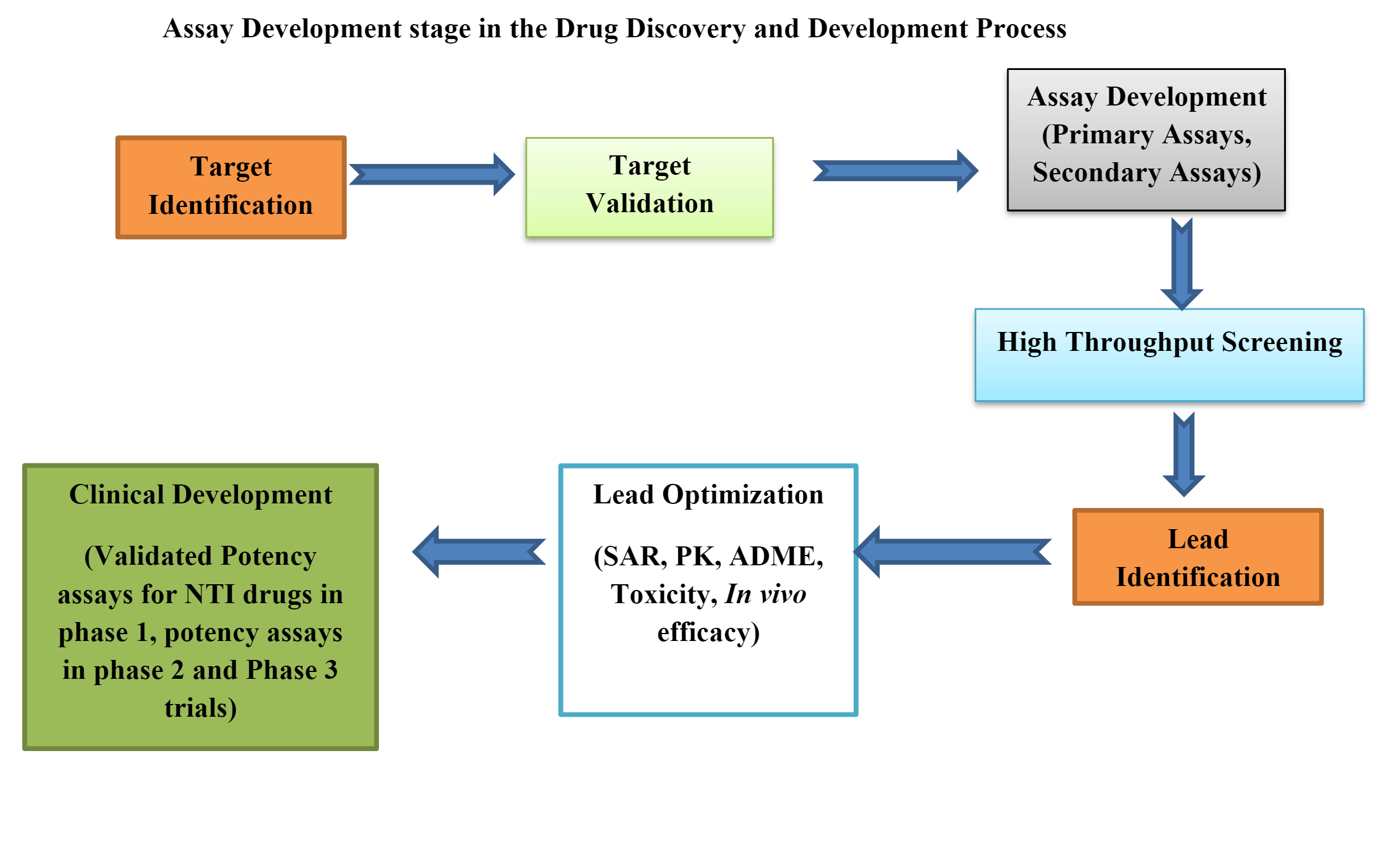
Bioanalytische Labore spielen eine entscheidende Rolle bei der Arzneimittelentwicklung und liefern wichtige Daten zur Beantwortung grundlegender Fragen wie „Funktioniert es?“ und „Ist es sicher?“ Die Geschwindigkeit, mit der Wissenschaftler fundierte Entscheidungen treffen können, wirkt sich direkt auf die Geschwindigkeit aus, mit der neue Medikamente auf den Markt gebracht werden. Um dieser Herausforderung zu begegnen, greifen Labore auf digitale Lösungen zurück, die Abläufe rationalisieren und die Datenqualität verbessern.
Die Macht der Daten freisetzen
Eines der wichtigsten Vermögenswerte in modernen bioanalytischen Labors sind Daten. Intelligentes Datenmanagement kann Zeit sparen, Verschwendung reduzieren und schnell zuverlässige Antworten liefern. In vielen Laboren sind die Daten jedoch auf verschiedene Systeme verteilt, darunter Notizbücher und Tabellenkalkulationen. Dieser fragmentierte Ansatz macht es schwierig, Daten effizient zu nutzen, was zu verpassten Chancen und Ineffizienzen führt.
Mit dem Aufkommen vernetzter Instrumente und fortschrittlicher Analyseinstrumente wie ELNs und LIMS können Labore ihre Daten nun in ein zentrales Backbone integrieren. Diese Integration ermöglicht optimierte Abläufe, weniger menschliche Fehler und eine verbesserte Datenzugänglichkeit. Durch die Zentralisierung von Daten können Labore benutzerfreundliche Berichte und Arbeitsabläufe erstellen, sodass Wissenschaftler schnellere und fundiertere Entscheidungen treffen können
Leistungsfähigkeit von ELN, LIMS und LES für die Bioanalyse
Die digitale Transformation bioanalytischer Labore wird durch den Einsatz von Laboratory Information Management Systems (LIMS), Electronic Lab Notebooks (ELN) und Laboratory Execution Systems (LES) erheblich erleichtert. Diese Systeme spielen eine entscheidende Rolle bei der Rationalisierung von Abläufen, der Verbesserung der Datenqualität und der Verbesserung von Entscheidungsprozessen.
LIMS (Laborinformationsmanagementsysteme):
LIMS sind von zentraler Bedeutung für die Umsetzung einer digitalen Strategie in bioanalytischen Laboren. Sie bieten einen strukturierten Rahmen für die Verwaltung von Probeninformationen während ihres gesamten Lebenszyklus. Durch die Verfolgung der Probendetails von der Anmeldung bis zur Entsorgung stellt LIMS sicher, dass die Daten genau und konsistent erfasst werden. Dieser zentralisierte Ansatz zur Datenverwaltung verbessert die Datenintegrität und -zugänglichkeit und ermöglicht es Wissenschaftlern, fundierte Entscheidungen effizienter zu treffen.
LIMS spielen eine Schlüsselrolle bei der Integration von Daten aus verschiedenen Quellen, wie Instrumenten, Tests und Experimenten. Durch die Bereitstellung einer einheitlichen Plattform für die Datenspeicherung und -verwaltung ermöglicht LIMS Laboren, Abläufe zu rationalisieren und manuelle Fehler zu reduzieren. Diese Integration erleichtert auch die Einhaltung gesetzlicher Anforderungen, da Daten einfach überprüft und bis zu ihrer Quelle zurückverfolgt werden können.
Insgesamt trägt LIMS erheblich zur Effizienz und Effektivität bioanalytischer Labore bei und ermöglicht es ihnen, Daten effektiver zu nutzen und fundierte Entscheidungen zu treffen.
ELN (Elektronische Labornotizbücher):
ELNs sind ein weiteres wesentliches Werkzeug bei der digitalen Transformation bioanalytischer Labore. Sie bieten eine digitale Plattform für die Aufzeichnung und Verwaltung experimenteller Daten und ersetzen herkömmliche Labornotizbücher aus Papier. ELNs bieten gegenüber Papiernotizbüchern mehrere Vorteile, darunter die Möglichkeit, Arbeitsabläufe zu standardisieren, die Dateneingabe zu automatisieren und die Zusammenarbeit zwischen Wissenschaftlern zu erleichtern.
Einer der Hauptvorteile von ELNs ist ihre Fähigkeit, experimentelle Arbeitsabläufe zu standardisieren. Durch die Bereitstellung von Vorlagen für die Aufzeichnung experimenteller Details stellen ELNs sicher, dass die Daten konsistent und genau erfasst werden. Diese Standardisierung verbessert nicht nur die Datenqualität, sondern erleichtert auch die Suche und Analyse von Daten.
ELNs erleichtern auch die Zusammenarbeit zwischen Wissenschaftlern, indem sie eine zentrale Plattform für den Austausch und Zugriff auf experimentelle Daten bereitstellen. Dieser kollaborative Ansatz zur Datenverwaltung ermöglicht es Wissenschaftlern, effizienter und effektiver zu arbeiten, was zu schnelleren Entscheidungen und besseren Ergebnissen führt.
LES (Laboratory Execution Systems):
LES sind spezialisierte Systeme zur Automatisierung und Durchsetzung von Verfahrensschritten im Labor. Im Kontext bioanalytischer Labore spielen LES eine entscheidende Rolle dabei, sicherzustellen, dass Experimente konsistent und gemäß Standardarbeitsanweisungen (SOPs) durchgeführt werden.
Einer der Hauptvorteile von LES ist ihre Fähigkeit, die prozedurale Ausführung während des Tests zu erzwingen. Durch die Kapselung von SOPs in Software stellt LES sicher, dass jeder Schritt des Testprozesses aufgezeichnet und abgeschlossen wird, bevor mit dem nächsten Schritt fortgefahren wird. Dadurch wird nicht nur die Datenqualität verbessert, sondern auch das Risiko von Fehlern und Protokollabweichungen verringert.
LES erleichtern auch die Echtzeitüberwachung von Experimenten und ermöglichen es Wissenschaftlern, fundierte Entscheidungen auf der Grundlage aktueller Daten zu treffen. Diese Echtzeit-Rückkopplungsschleife ermöglicht es Laboren, schnell auf sich ändernde Bedingungen zu reagieren und experimentelle Arbeitsabläufe für bessere Ergebnisse zu optimieren
Verfeinerung bioanalytischer Labore: Vereinheitlichung digitaler Lösungen für Effizienz, Qualität und Innovation
1. Bieten Sie ein plattformbasiertes und dennoch personalisiertes Laborerlebnis
Während die Personalisierung von Labortechnologien kurzfristig von Vorteil sein kann, führt sie häufig zu Informationssilos und Herausforderungen beim Informationsaustausch. Ein plattformbasierter Ansatz hingegen ermöglicht es Laboren, integrierte Module zu nutzen, die auf unternehmensweite Standardterminologien und -funktionen für Forschung und Entwicklung abgestimmt sind. Dieser Ansatz, der durch Tools wie LIMS und ELNs erleichtert wird, ermöglicht eine bessere Generierung von Studiendaten und verbessert die Zusammenarbeit zwischen Forschern. Durch die Einführung harmonisierter Ansätze an allen Standorten können Labore eine verbesserte Sichtbarkeit, eine Echtzeitverfolgung des Experimentstatus und verbesserte experimentelle Einblicke erreichen.
2. Nutzen Sie digitale Labortools, um betriebliche Effizienz und Kosteneinsparungen zu erzielen
Digitale Labortechnologien wie LIMS, ELNs und Qualitätsmanagementsysteme bieten erhebliche betriebliche Effizienz und Möglichkeiten zur Kosteneinsparung. Durch die Abschaffung veralteter Systeme, die Eliminierung redundanter Dateneingaben und die Erstellung von Prüfprotokollen können Labore Arbeitsabläufe rationalisieren, die Datengenauigkeit sicherstellen und die Einhaltung gesetzlicher Anforderungen verbessern. Darüber hinaus reduzieren diese Technologien den Zeitaufwand der Mitarbeiter für manuelle Aufgaben und ermöglichen die Echtzeitverfolgung der Projektarbeitsbelastung, was zu erheblichen Zeiteinsparungen pro Mitarbeiter führt.
3. Fördern Sie eine verbesserte Datenreproduzierbarkeit und Datenanalyse, um kommerziellen Wert zu schaffen
Die Reproduzierbarkeit von Daten ist eine entscheidende Herausforderung in bioanalytischen Labors und führt zu Zeitverschwendung, geringeren Ressourcen und geringerem wissenschaftlichen Output. Digitale Plattformen, die die Datenqualität verbessern und die statistische Aussagekraft steigern, können dieser Herausforderung begegnen. Durch die Standardisierung von Daten höherer Qualität können Labore die Reproduzierbarkeit erhöhen und die experimentelle Leistung verbessern. Darüber hinaus kann der Einsatz von Datenanalysetools Laboren dabei helfen, einen Mehrwert aus ihren Daten zu ziehen und so die Entdeckung neuer Indikationen und Moleküle zu beschleunigen.
Veedas Integration von LIMS-, ELN- und LES-Lösungen
Die Bioanalyselösung von Veeda integriert Funktionen des Laboratory Information Management System (LIMS), des Electronic Laboratory Notebook (ELN) und des Laboratory Execution System (LES), um unsere bioanalytischen Laborabläufe zu optimieren. Dieser integrierte Ansatz für bioanalytische Studien bietet fortschrittliche Datenverwaltungs-, Analyse- und Automatisierungstools in einem einzigen, zusammenhängenden System.
LIMS zentralisiert die Probenverfolgung und Datenverwaltung und gewährleistet so die Rückverfolgbarkeit und die Einhaltung gesetzlicher Standards. Unterdessen digitalisiert ELN experimentelle Daten, verbessert die Zusammenarbeit und reduziert manuelle Fehler. Das LES verbessert unsere Arbeitsabläufe weiter, indem es Prozesse automatisiert und SOPs durchsetzt und so Konsistenz und Qualität in unseren Abläufen gewährleistet. Durch diese Integration werden unsere bioanalytischen Verfahren zu effizienten, zuverlässigen Testmethoden, bei denen wir vernetzte Instrumente und intelligente Datenverwaltungsfunktionen nutzen, um unsere Ergebnisse kontinuierlich zu verbessern.
Referenzartikel:
https://www.technologynetworks.com/informatics/articles/eln-lims-cds-les-whats-the-difference-313834
https://www.labware.com/blog/streamlining-bioanalytical-testing-with-a-unified-lims-and-eln-solution