使用 ELNS、LES 和 LIMS 软件优化生物分析实验室
2024 年 4 月 30 日

印度正在成为一个具有为国家和国际临床试验平台做出贡献的巨大潜力的国家。
中央药品标准控制组织 (CDSCO) 是印度的国家监管机构,由印度药品监管总局 (DCGI) 管理。1,2,3
DCGI 负责协调赞助商、制造单位以及试验场地的检查。3
2000 年,印度医学研究委员会 (ICMR) 制定了针对人体进行生物医学研究的道德准则。4 2005 年,对 1945 年《药品和化妆品法》的附表 Y 进行了修订,以使印度监管法律与国际公认的定义和程序保持一致。
这些变化包括:
印度还于2005年签署了与贸易有关的知识产权(TRIPS)协议,以开辟在印度开展更多临床试验的前景。5
除了将监管行为与国际标准相协调外,印度还迅速成为临床试验的有利目的地,因为它提供了:6
尽管法规发生了变化,许多跨国制药公司还是利用了对临床试验知识不足或文盲的大量人口。 此外,不明确的医疗保健系统也增加了监控不道德行为的挑战。
这导致临床试验在几乎没有监督的情况下进行,并且没有以书面或音频/视频内容记录患者知情同意。
患者接受了研究药物或装置,但没有披露已知的严重不良反应,其中一些不良反应导致受试者死亡。 此外,没有成立独立调查委员会来确定患者的死亡是否与研究产品或设备相关。4
2010年至2013年是一个艰难的阶段 印度临床试验 由于进行不道德试验的累积不良影响而出现的情况。
然而,随着更好的监管框架的到位,印度临床试验注册中心 (CTRI) 记录的正在进行的试验数量稳步上升,如图 1 所示。还观察到,大多数试验都是 III 期试验试验。7
数字 1: 历年临床试验趋势
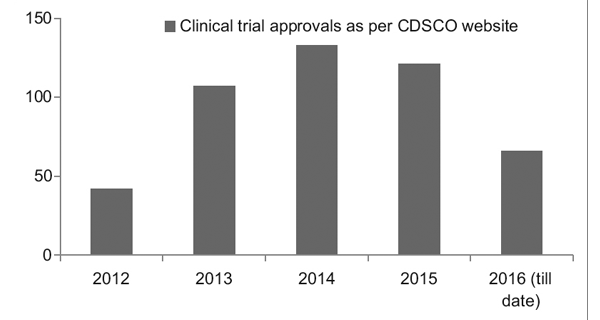
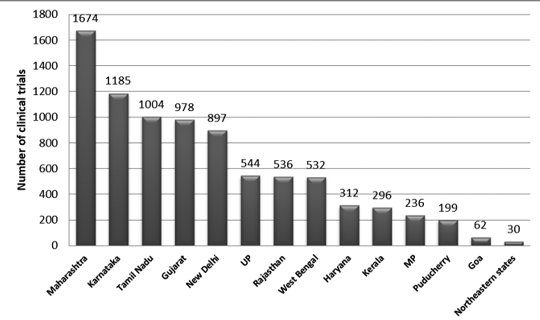
图 2 显示了 2007 年至 2015 年间印度试验的各州分布。在此期间注册了大约 3330 项试验。
据观察,马哈拉施特拉邦进行的试验数量最多,东北部邦进行的试验数量最少。 在东北部各州中,那加兰邦没有进行任何试验。7
数字 2: 印度临床试验的州分布(2007-2015年数据)7
2014年,CDSCO下设12个新药咨询委员会(NDAC)和25个学科专家委员会(SEC)。 这些委员会拥有多位来自知名政府学院和机构的专家,可将临床试验的审批时间缩短至 6-7 个月。
三层流程包括:9
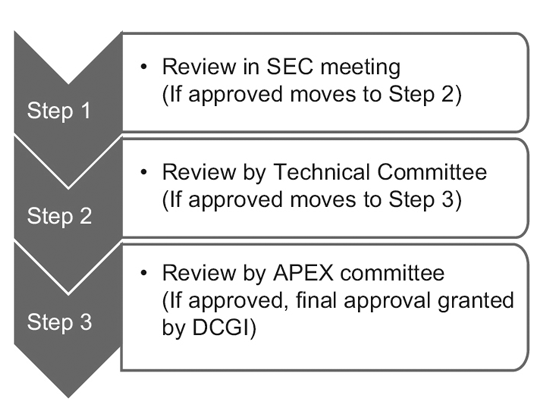
不过,只有 SEC 审查全球临床试验申请,不需要技术委员会或 Apex 委员会的进一步批准。 研究性新药(IND)申请也由 IND 委员会独立审查,不需要 Apex 委员会的批准。
仅当 SEC 拒绝赞助商的申请并且赞助商对该决定感到不满时,技术委员会才会介入。 在这种情况下,如果技术委员会不同意 SEC 的决定,它有权推翻 SEC 的决定。10
2019年XNUMX月,印度卫生和家庭福利部发布 新药及临床试验规则 2019 年,旨在快速批准临床试验、新药、生物等效性 (BE) 或生物利用度 (BA) 研究。
这些规则还解决了道德委员会 (EC) 监管中存在的任何含糊之处。11
2019年新药及临床试验规则要点11 |
更新的规则和规定11 |
临床试验批准时间表 |
对于印度境外发现的药物,自收到申请后 90 个工作日;对于印度境内的新药或 IND,自收到申请起 30 个工作日 |
新药制造或 IND、BE 和 BA 研究或测试分析或检查 |
需要获得中央许可机构 (CLA) 的许可 |
豁免本地临床试验 |
· CLA是否已批准该新药在其他国家上市或已批准该新药在印度进行全球临床试验 · 没有证据表明印度人群的遗传特征差异导致新陈代谢、安全性或功效存在差异 |
临床试验的有效期 |
自 CLA 签发之日起 2 年 |
试验后获得 IND 或新药 |
在特殊情况下,药物将根据 CLA 的指示免费分发给试验受试者,但申办者对试验后药物的使用不承担任何责任。 |
提交前和提交后会议 |
寻求有关管理制造和许可或授予许可过程的法律和程序的指导。 |
批准 EC 进行的试验并进行 EC 注册 |
· 如果试验地点没有EC,则需获得另一个试验地点EC的批准,且EC应在试验地点50公里以内。· CLA 批准的 EC 注册自颁发之日起五年内有效。 |
进行临床试验应满足的条件 |
· 每季度或根据试验持续时间提交状态报告以跟踪受试者注册情况· 每六个月通过 SUGHAM 门户在线报告临床试验的状态,以了解试验是否正在进行、已完成或已终止。 |
获取许可证、注册证书和试用许可的费用 |
根据试验目的不同的费用结构。 费用从 50,000 印度卢比到 5,00,000 印度卢比不等。 |
处理临床试验的挑战是多方面的,涉及利益相关者、政府和司法系统等以负责任和道德的方式遵守监管框架。
患者安全和保护 最重要的是制定严格的规则:12
新的基本规则 可以开辟在印度扩大医学研究的可能性的是:13
熟练的劳动力和最先进的基础设施 在吸引赞助企业方面也发挥着重要作用。 研究表明,尽管印度正在大规模进行第三阶段试验,但第一阶段试验似乎仅限于申办国。
这可能是由于赞助商对采购合格的劳动力和技术感到担忧。 为了使本土研究能够在印度进行,至关重要的是向人员提供适当的接触或继续医学教育,并获得最新技术,以便被认为是一个有能力进行任何阶段试验的国家。9
同样重要的是需要在全国范围内提供熟练的医疗保健工作者,以解决各州临床试验分布不均的问题。
将试验集中在特定州可能会导致有偏见的结论,并过度简化或夸大疾病负担或状况。 通过为所有州的人们提供参加临床试验的机会,我们不仅最大限度地减少了偏见,而且还包括不同种族的人群。9
凭借积极、患者友好、快速和透明的监管法律,印度将继续发展成为测试和开发创新药物和医疗设备的国际中心。
1. 伊万杰琳·L、莫妮卡·NVN、雷迪 VS 等。 印度临床试验的监管流程和伦理(CDSCO)。 医药创新杂志. 2017;6(4):165-9. http://www.thepharmajournal.com/archives/2017/vol6issue4/PartC/6-4-4-176.pdf
2.拉希里·S、辛哈·R、乔杜里·S 等。 印度临床试验法规的范式转变。 印度风湿病学杂志。 2018; 13:51-5。
3. Gogtay NJ、Ravi R 和 Thatte UM。 印度临床试验的监管要求:院士需要了解什么。 印度麻醉杂志. 2017 Mar;61(3):192-9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5372399/
4. Ramu B、Kumar MS 和 Ramakrishna N。当前在印度开展临床试验的监管情景。 药品监管事务。 开放获取。 2015; 4:2。 https://www.researchgate.net/publication/281765214_Current_Regulatory_Scenario_for_Conducting_Clinical_Trials_in_India
5. 伯特·T、夏尔马·P、迪伦·S 等。 印度的临床研究环境:挑战和建议的解决方案。 临床研究生物伦理学杂志。 2014;5:6。 DOI:10.4172/2155-9627.1000201
6. Chaturvedi M,Gogtay NJ,Thatte UM。 印度进行的临床试验是否符合其医疗保健需求? 对印度临床试验注册中心的审计。 临床研究的观点. 2017;8(4):172-5.
7. http://ctri.nic.in/Clinicaltrials/news/CTRI_Newsbulletin_July-Dec_2017.pdf 访问日期:23 年 2019 月 XNUMX 日。
8. Bhave A 和 Menon S。临床研究的监管环境:最近的过去和预期的未来。 临床研究的观点。 2017; 8:11.6。
9. 2019年新药及临床试验规则要点。23年2019月XNUMX日访问
10. Dan S、Karmakar S、Ghosh B 等。 印度临床试验的数字化:CDSCO 在确保数据可信度和患者安全方面迈出的新一步。 药品监管事务:开放获取。 2015;4(3):DOI:10.4172/2167-7689.1000149。
11. https://www.thehindubusinessline.com/news/new-rules-sweeten-the-deal-for-clinical-trials-by-indian-pharma-cos/article26283499.ece 23 年 2019 月 XNUMX 日访问。
本文中包含的信息仅旨在为读者个人使用感兴趣的问题提供一般指导,读者对其使用承担全部责任。 因此,提供本文中的信息的前提是作者和出版商在此不提供专业建议或服务。
因此,它不应替代与有能力的顾问的咨询。 在做出任何决定或采取任何行动之前,读者应始终咨询与相关文章发布相关的专业顾问。
虽然我们已尽一切努力确保本文中包含的信息是从可靠来源获得的,但 Veeda Clinical Research 对任何错误或遗漏或使用此信息所获得的结果不承担任何责任。
本文中的所有信息均“按原样”提供,不保证完整性、准确性、及时性或使用此信息所获得的结果,也不提供任何形式的明示或暗示的保证,包括但不限于性能、适销性和特定用途适用性的保证。
本文中的任何内容均不得在任何程度上替代读者的独立调查以及合理的技术和商业判断。 在任何情况下都不会 韦达临床研究或其合作伙伴、员工或代理对读者或任何其他人依据本文中的信息做出的任何决定或采取的行动或任何间接的、特殊的或类似的损害负责,即使已被告知这种可能性此类损害。
未经出版商事先书面许可,不得复制本出版物的任何部分、将其存储在检索系统中或以任何形式或任何方式(机械、电子、复印、录音或其他方式)传播。
如需信息,请联系我们::
Veeda 临床研究私人有限公司
Vedant Complex,YMCA 俱乐部旁边,SG 高速公路,
维贾尔普尔,艾哈迈达巴德 – 380 051,
印度古吉拉特邦。
Phone: +91-79-3001-3000
传真:+91-79-3001-3010
电子邮箱: info@veedacr.com
