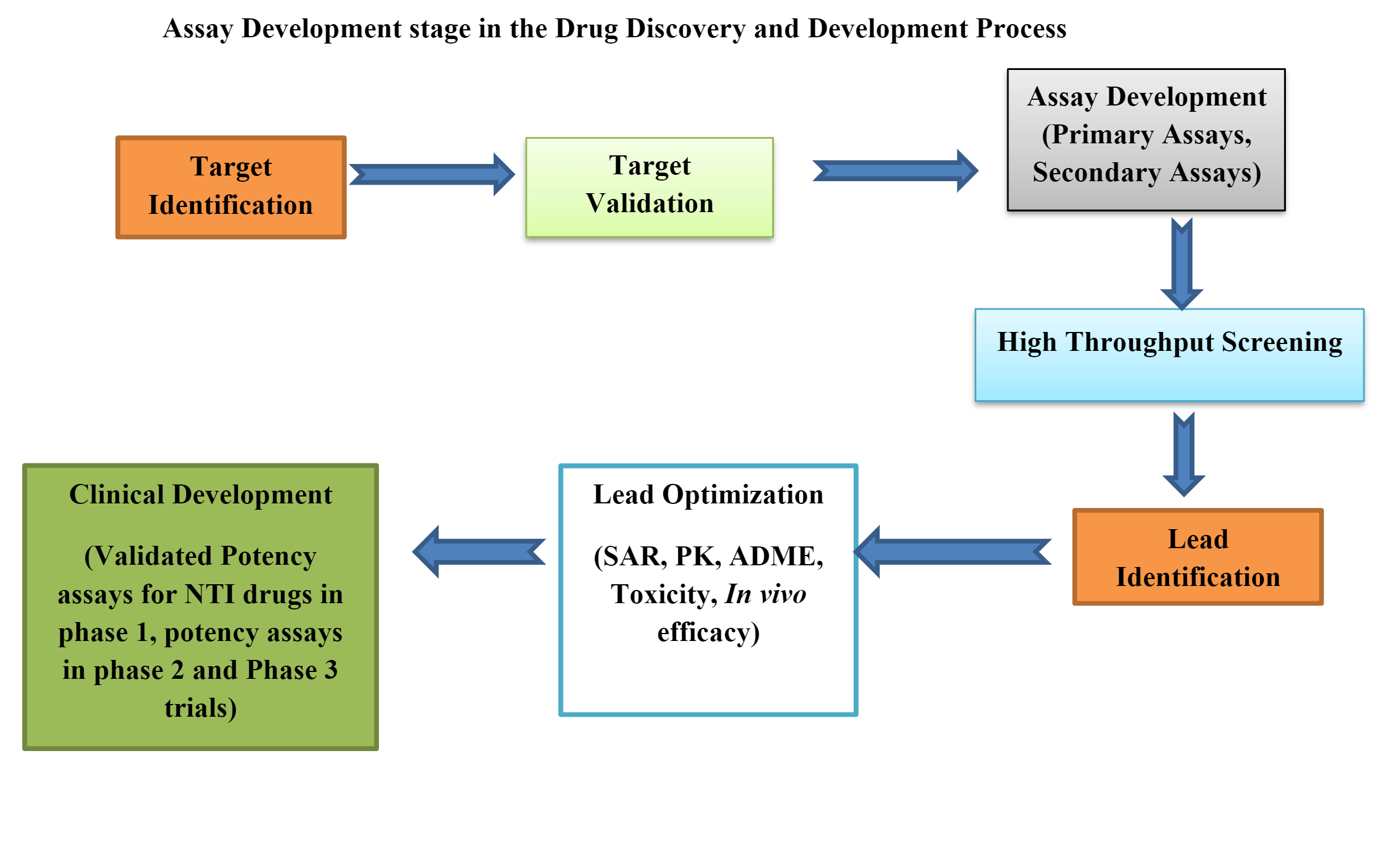
Les laboratoires de bioanalyse jouent un rôle crucial dans le développement de médicaments, en fournissant des données essentielles pour répondre à des questions fondamentales telles que « Est-ce que ça marche ? et "Est-ce sûr?" La rapidité avec laquelle les scientifiques peuvent prendre des décisions éclairées a un impact direct sur le rythme de mise sur le marché de nouveaux médicaments. Pour relever ce défi, les laboratoires se tournent vers des solutions numériques qui rationalisent les opérations et améliorent la qualité des données.
Libérer le pouvoir des données
Les données constituent l’un des principaux atouts des laboratoires de bioanalyse modernes. La gestion intelligente des données peut permettre de gagner du temps, de réduire le gaspillage et de fournir rapidement des réponses fiables. Cependant, dans de nombreux laboratoires, les données sont dispersées sur différents systèmes, notamment des blocs-notes papier et des feuilles de calcul. Cette approche fragmentée rend difficile l’exploitation efficace des données, ce qui entraîne des opportunités manquées et des inefficacités.
Avec l’essor des instruments connectés et des instruments analytiques avancés comme les ELN et les LIMS, les laboratoires peuvent désormais intégrer leurs données dans une structure centrale. Cette intégration permet des opérations rationalisées, une réduction des erreurs humaines et une meilleure accessibilité aux données. En centralisant les données, les laboratoires peuvent créer des rapports et des flux de travail conviviaux, permettant aux scientifiques de prendre des décisions plus rapides et plus éclairées.
Puissance de l'ELN, du LIMS et des LES pour la bioanalyse
La transformation numérique des laboratoires de bioanalyse est grandement facilitée par l'utilisation de systèmes de gestion de l'information de laboratoire (LIMS), de cahiers électroniques de laboratoire (ELN) et de systèmes d'exécution de laboratoire (LES). Ces systèmes jouent un rôle crucial dans la rationalisation des opérations, l’amélioration de la qualité des données et l’amélioration des processus décisionnels.
LIMS (Systèmes de gestion des informations de laboratoire) :
Les LIMS sont au cœur de la mise en œuvre d’une stratégie numérique dans les laboratoires de bioanalyse. Ils fournissent un cadre structuré pour gérer les informations sur les échantillons tout au long de leur cycle de vie. En suivant les détails des échantillons depuis la connexion jusqu'à la disposition, LIMS garantit que les données sont capturées avec précision et cohérence. Cette approche centralisée de la gestion des données améliore l’intégrité et l’accessibilité des données, permettant ainsi aux scientifiques de prendre des décisions éclairées plus efficacement.
Les LIMS jouent un rôle clé dans l'intégration de données provenant de diverses sources, telles que des instruments, des tests et des expériences. En fournissant une plate-forme unifiée pour le stockage et la gestion des données, LIMS permet aux laboratoires de rationaliser les opérations et de réduire les erreurs manuelles. Cette intégration facilite également la conformité aux exigences réglementaires, car les données peuvent être facilement auditées et retracées jusqu'à leur source.
Dans l’ensemble, LIMS contribue de manière significative à l’efficience et à l’efficacité des laboratoires de bioanalyse, leur permettant d’exploiter les données plus efficacement et de prendre des décisions éclairées.
ELN (Cahiers de laboratoire électroniques) :
Les ELN sont un autre outil essentiel dans la transformation numérique des laboratoires de bioanalyse. Ils fournissent une plate-forme numérique pour l’enregistrement et la gestion des données expérimentales, remplaçant les cahiers de laboratoire papier traditionnels. Les ELN offrent plusieurs avantages par rapport aux cahiers papier, notamment la possibilité de standardiser les flux de travail, d'automatiser la saisie des données et de faciliter la collaboration entre scientifiques.
L’un des principaux avantages des ELN est leur capacité à standardiser les flux de travail expérimentaux. En fournissant des modèles pour enregistrer les détails expérimentaux, les ELN garantissent que les données sont capturées de manière cohérente et précise. Cette standardisation améliore non seulement la qualité des données, mais facilite également la recherche et l'analyse des données.
Les ELN facilitent également la collaboration entre scientifiques en fournissant une plate-forme centrale pour le partage et l'accès aux données expérimentales. Cette approche collaborative de la gestion des données permet aux scientifiques de travailler plus efficacement, ce qui conduit à une prise de décision plus rapide et à de meilleurs résultats.
LES (Systèmes d'Exécution de Laboratoire) :
Les LES sont des systèmes spécialisés conçus pour automatiser et appliquer les étapes procédurales dans le laboratoire. Dans le contexte des laboratoires de bioanalyse, les LES jouent un rôle crucial en garantissant que les expériences sont menées de manière cohérente et conformément aux procédures opérationnelles standard (SOP).
L'un des principaux avantages des LES est leur capacité à imposer l'exécution de procédures pendant les tests. En encapsulant les SOP dans un logiciel, les LES s'assurent que chaque étape du processus de test est enregistrée et terminée avant de passer à l'étape suivante. Cela améliore non seulement la qualité des données, mais réduit également le risque d’erreurs et d’écarts par rapport au protocole.
LES facilitent également le suivi en temps réel des expériences, permettant aux scientifiques de prendre des décisions éclairées basées sur des données à jour. Cette boucle de rétroaction en temps réel permet aux laboratoires de réagir rapidement aux conditions changeantes et d'optimiser les flux de travail expérimentaux pour de meilleurs résultats
Affiner les laboratoires bioanalytiques : unifier les solutions numériques pour l'efficacité, la qualité et l'innovation
1. Offrez une expérience de laboratoire basée sur une plateforme mais personnalisée
Même si la personnalisation des technologies de laboratoire peut être bénéfique à court terme, elle conduit souvent à des silos d’informations et à des défis dans l’échange d’informations. Une approche basée sur une plateforme, en revanche, permet aux laboratoires d'exploiter des modules intégrés alignés sur les terminologies et les capacités standard de R&D à l'échelle de l'entreprise. Cette approche, facilitée par des outils comme LIMS et ELN, permet une génération de données d'étude de meilleure qualité et améliore la collaboration entre les chercheurs. En adoptant des approches harmonisées sur tous les sites, les laboratoires peuvent obtenir une visibilité améliorée, un suivi en temps réel des statuts des expériences et de meilleures informations inter-expérimentales.
2. Tirez parti des outils de laboratoire numérique pour libérer l’efficacité opérationnelle et réaliser des économies
Les technologies de laboratoire numérique telles que LIMS, ELN et les systèmes de gestion de la qualité offrent des efficacités opérationnelles significatives et des opportunités de réduction des coûts. En retirant les systèmes existants, en éliminant la saisie de données redondante et en créant des pistes d'audit, les laboratoires peuvent rationaliser les flux de travail, garantir l'exactitude des données et améliorer la conformité aux exigences réglementaires. De plus, ces technologies réduisent le temps consacré aux tâches manuelles et permettent un suivi en temps réel des charges de travail des projets, ce qui entraîne un gain de temps substantiel par employé.
3. Améliorer la reproductibilité et l'analyse des données pour créer de la valeur commerciale
La reproductibilité des données constitue un défi crucial dans les laboratoires de bioanalyse, entraînant une perte de temps, une diminution des ressources et une diminution de la production scientifique. Les plateformes numériques qui améliorent la qualité des données et augmentent la puissance statistique peuvent relever ce défi. En standardisant des données de meilleure qualité, les laboratoires peuvent augmenter la reproductibilité et améliorer les performances expérimentales. De plus, l’exploitation des outils d’analyse de données peut aider les laboratoires à extraire une valeur supplémentaire de leurs données, accélérant ainsi la découverte de nouvelles indications et molécules.
Intégration par Veeda des solutions LIMS, ELN et LES
La solution de bioanalyse de Veeda intègre les fonctionnalités du système de gestion des informations de laboratoire (LIMS), du cahier électronique de laboratoire (ELN) et du système d'exécution de laboratoire (LES) pour optimiser nos opérations de laboratoire de bioanalyse. Cette approche intégrée pour les études bioanalytiques en fournissant des outils avancés de gestion des données, d’analyse et d’automatisation dans un système unique et cohérent.
LIMS centralise le suivi des échantillons et la gestion des données, garantissant ainsi la traçabilité et le respect des normes réglementaires. Pendant ce temps, l’ELN numérise les données expérimentales, améliorant ainsi la collaboration et réduisant les erreurs manuelles. Les LES améliorent encore nos flux de travail en automatisant les processus et en appliquant les SOP, garantissant ainsi la cohérence et la qualité de nos opérations. Cette intégration améliore nos procédures bioanalytiques en méthodes de test efficaces et fiables, dans lesquelles nous exploitons des instruments connectés et des capacités de gestion intelligente des données pour améliorer constamment nos résultats livrables.
Articles de référence :
https://www.technologynetworks.com/informatics/articles/eln-lims-cds-les-whats-the-difference-313834
https://www.labware.com/blog/streamlining-bioanalytical-testing-with-a-unified-lims-and-eln-solution