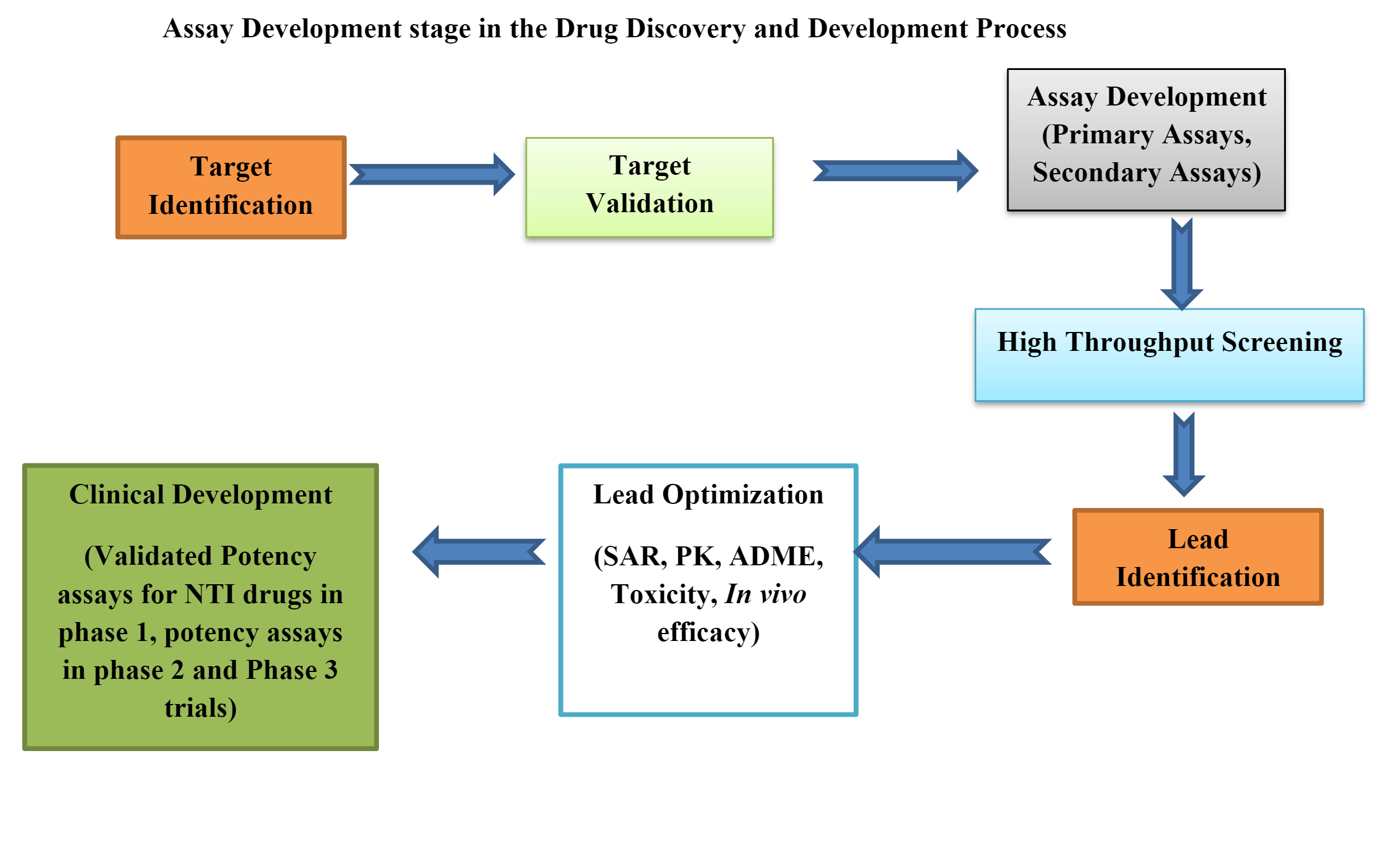
Los laboratorios bioanalíticos desempeñan un papel crucial en el desarrollo de fármacos, proporcionando datos esenciales para responder preguntas fundamentales como "¿Funciona?" y "¿Es seguro?" La velocidad a la que los científicos pueden tomar decisiones informadas influye directamente en el ritmo de comercialización de nuevos medicamentos. Para afrontar este desafío, los laboratorios están recurriendo a soluciones digitales que agilizan las operaciones y mejoran la calidad de los datos.
Desbloqueando el poder de los datos
Uno de los activos clave de los laboratorios bioanalíticos modernos son los datos. La gestión inteligente de datos puede ahorrar tiempo, reducir el desperdicio y proporcionar respuestas confiables rápidamente. Sin embargo, en muchos laboratorios, los datos están dispersos en varios sistemas, incluidos cuadernos de papel y hojas de cálculo. Este enfoque fragmentado dificulta el aprovechamiento de los datos de manera eficiente, lo que genera ineficiencias y oportunidades perdidas.
Con el auge de los instrumentos conectados y los instrumentos analíticos avanzados como ELN y LIMS, los laboratorios ahora pueden integrar sus datos en una columna central. Esta integración permite operaciones optimizadas, reducción de errores humanos y mejor accesibilidad a los datos. Al centralizar los datos, los laboratorios pueden crear informes y flujos de trabajo fáciles de usar, lo que permite a los científicos tomar decisiones más rápidas y mejor informadas.
Poder de ELN, LIMS y LES para bioanálisis
La transformación digital de los laboratorios bioanalíticos se ve facilitada enormemente por el uso de sistemas de gestión de información de laboratorio (LIMS), cuadernos de laboratorio electrónicos (ELN) y sistemas de ejecución de laboratorio (LES). Estos sistemas desempeñan funciones cruciales a la hora de agilizar las operaciones, mejorar la calidad de los datos y mejorar los procesos de toma de decisiones.
LIMS (Sistemas de Gestión de Información de Laboratorio):
Los LIMS son fundamentales para la implementación de una estrategia digital en los laboratorios bioanalíticos. Proporcionan un marco estructurado para gestionar información de muestra a lo largo de su ciclo de vida. Al rastrear los detalles de las muestras desde el inicio de sesión hasta su disposición, LIMS garantiza que los datos se capturen de manera precisa y consistente. Este enfoque centralizado de la gestión de datos mejora la integridad y la accesibilidad de los datos, lo que permite a los científicos tomar decisiones informadas de manera más eficiente.
LIMS desempeña un papel clave en la integración de datos de diversas fuentes, como instrumentos, ensayos y experimentos. Al proporcionar una plataforma unificada para el almacenamiento y la gestión de datos, LIMS permite a los laboratorios optimizar las operaciones y reducir los errores manuales. Esta integración también facilita el cumplimiento de los requisitos reglamentarios, ya que los datos se pueden auditar y rastrear fácilmente hasta su fuente.
En general, LIMS contribuye significativamente a la eficiencia y eficacia de los laboratorios bioanalíticos, permitiéndoles aprovechar los datos de manera más efectiva y tomar decisiones informadas.
ELN (Cuadernos de Laboratorio Electrónicos):
Los ELN son otra herramienta esencial en la transformación digital de los laboratorios bioanalíticos. Proporcionan una plataforma digital para registrar y gestionar datos experimentales, reemplazando los cuadernos de laboratorio de papel tradicionales. Los ELN ofrecen varias ventajas sobre los cuadernos de papel, incluida la capacidad de estandarizar los flujos de trabajo, automatizar la entrada de datos y facilitar la colaboración entre científicos.
Uno de los beneficios clave de los ELN es su capacidad para estandarizar los flujos de trabajo experimentales. Al proporcionar plantillas para registrar detalles experimentales, los ELN garantizan que los datos se capturen de manera consistente y precisa. Esta estandarización no solo mejora la calidad de los datos sino que también facilita la búsqueda y el análisis de datos.
Los ELN también facilitan la colaboración entre científicos al proporcionar una plataforma central para compartir y acceder a datos experimentales. Este enfoque colaborativo para la gestión de datos permite a los científicos trabajar de manera más eficiente y efectiva, lo que conduce a una toma de decisiones más rápida y mejores resultados.
LES (Sistemas de Ejecución de Laboratorio):
LES son sistemas especializados diseñados para automatizar y hacer cumplir los pasos de los procedimientos en el laboratorio. En el contexto de los laboratorios bioanalíticos, los LES desempeñan un papel crucial a la hora de garantizar que los experimentos se realicen de forma coherente y de acuerdo con los procedimientos operativos estándar (SOP).
Una de las ventajas clave de LES es su capacidad para hacer cumplir la ejecución de procedimientos durante las pruebas. Al encapsular los SOP en software, LES garantiza que cada paso del proceso de prueba se registre y se complete antes de pasar al siguiente. Esto no sólo mejora la calidad de los datos sino que también reduce el riesgo de errores y desviaciones del protocolo.
LES también facilita el seguimiento de los experimentos en tiempo real, lo que permite a los científicos tomar decisiones informadas basadas en datos actualizados. Este circuito de retroalimentación en tiempo real permite a los laboratorios responder rápidamente a las condiciones cambiantes y optimizar los flujos de trabajo experimentales para obtener mejores resultados.
Refinamiento de laboratorios bioanalíticos: unificación de soluciones digitales para eficiencia, calidad e innovación
1. Ofrezca una experiencia de laboratorio personalizada y basada en una plataforma
Si bien la personalización de las tecnologías de laboratorio puede ser beneficiosa a corto plazo, a menudo genera silos de información y desafíos en el intercambio de información. Por otro lado, un enfoque basado en plataforma permite a los laboratorios aprovechar módulos integrados alineados con terminologías y capacidades estándar de I+D en toda la empresa. Este enfoque, facilitado por herramientas como LIMS y ELN, permite la generación de datos de estudio de mejor calidad y mejora la colaboración entre investigadores. Al adoptar enfoques armonizados en todos los sitios, los laboratorios pueden lograr una visibilidad mejorada, un seguimiento en tiempo real de los estados de los experimentos y conocimientos interexperimentales mejorados.
2. Aproveche las herramientas del laboratorio digital para desbloquear la eficiencia operativa y el ahorro de costos
Las tecnologías de laboratorio digital como LIMS, ELN y los sistemas de gestión de calidad ofrecen importantes eficiencias operativas y oportunidades de ahorro de costos. Al retirar los sistemas heredados, eliminar la entrada de datos redundantes y crear pistas de auditoría, los laboratorios pueden optimizar los flujos de trabajo, garantizar la precisión de los datos y mejorar el cumplimiento de los requisitos normativos. Además, estas tecnologías reducen el tiempo que los empleados dedican a tareas manuales y permiten el seguimiento en tiempo real de las cargas de trabajo del proyecto, lo que genera ahorros sustanciales de tiempo por empleado.
3. Impulsar una reproducibilidad y un análisis de datos mejorados para crear valor comercial
La reproducibilidad de los datos es un desafío crítico en los laboratorios bioanalíticos, lo que genera pérdida de tiempo, disminución de recursos y menor producción científica. Las plataformas digitales que mejoran la calidad de los datos y aumentan el poder estadístico pueden abordar este desafío. Al estandarizar datos de mayor calidad, los laboratorios pueden aumentar la reproducibilidad y mejorar el rendimiento experimental. Además, aprovechar las herramientas de análisis de datos puede ayudar a los laboratorios a extraer valor adicional de sus datos, acelerando el descubrimiento de nuevas indicaciones y moléculas.
Integración de Veeda de soluciones LIMS, ELN y LES
La solución de bioanálisis de Veeda integra las funcionalidades del Sistema de gestión de información de laboratorio (LIMS), el Cuaderno electrónico de laboratorio (ELN) y el Sistema de ejecución de laboratorio (LES) para optimizar las operaciones de nuestro laboratorio bioanalítico. Este enfoque integrado para estudios bioanalíticos proporciona herramientas avanzadas de automatización, análisis y gestión de datos en un sistema único y cohesivo.
LIMS centraliza el seguimiento de muestras y la gestión de datos, asegurando la trazabilidad y el cumplimiento de los estándares regulatorios. Mientras tanto, ELN digitaliza datos experimentales, mejorando la colaboración y reduciendo los errores manuales. LES mejora aún más nuestros flujos de trabajo al automatizar procesos y hacer cumplir los SOP, garantizando coherencia y calidad en nuestras operaciones. Esta integración mejora nuestros procedimientos bioanalíticos y los convierte en métodos de prueba eficientes y confiables, donde aprovechamos los instrumentos conectados y las capacidades de gestión inteligente de datos para mejorar constantemente nuestros resultados entregables.
Artículos de referencia:
https://www.technologynetworks.com/informatics/articles/eln-lims-cds-les-whats-the-difference-313834
https://www.labware.com/blog/streamlining-bioanalytical-testing-with-a-unified-lims-and-eln-solution