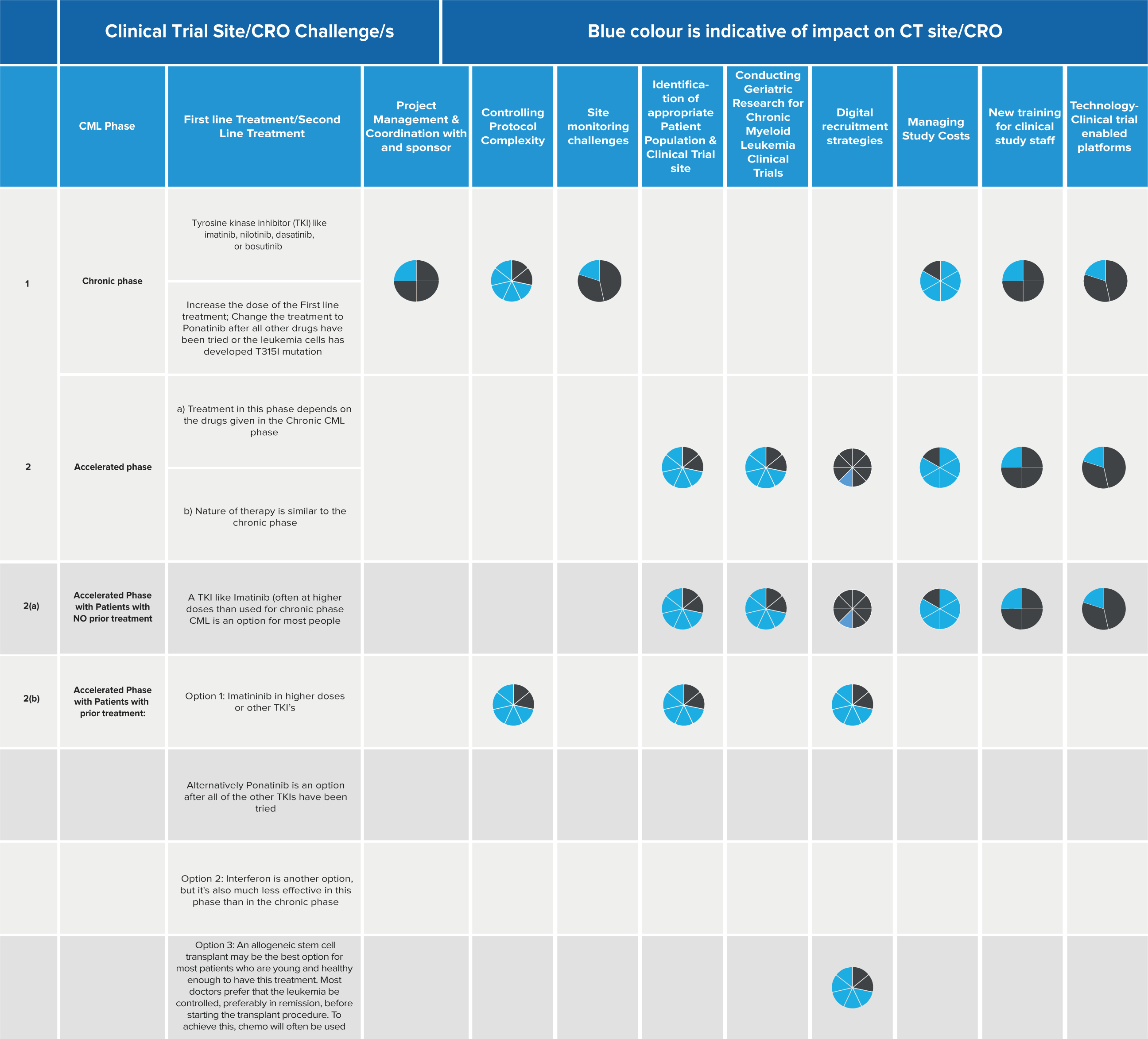
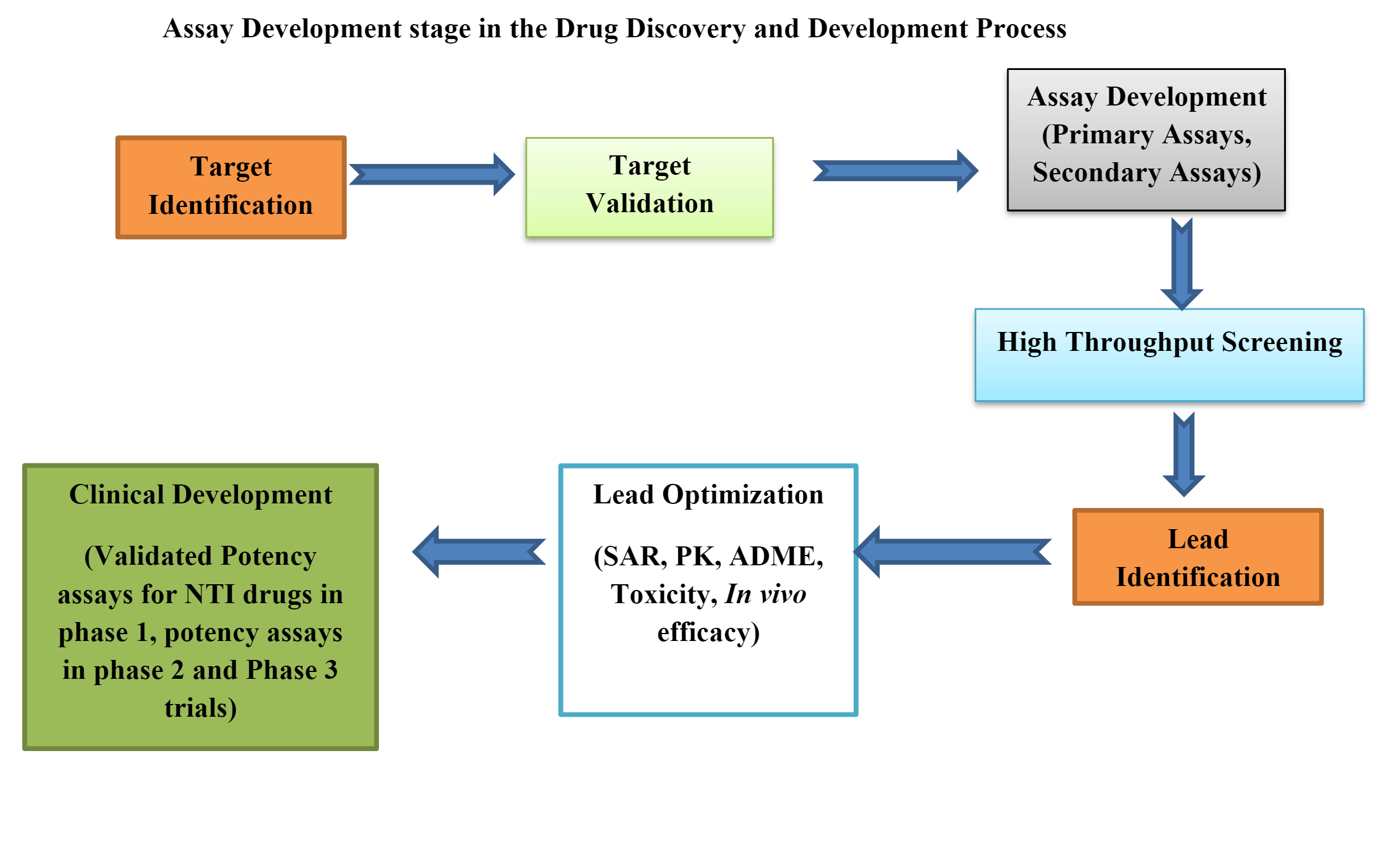
Bioanalytiska laboratorier spelar en avgörande roll i läkemedelsutvecklingen och tillhandahåller viktiga data för att svara på grundläggande frågor som "Fungerar det?" och "Är det säkert?" Den hastighet med vilken forskare kan fatta välgrundade beslut påverkar direkt takten i att få ut nya läkemedel på marknaden. För att möta denna utmaning vänder sig labb till digitala lösningar som effektiviserar verksamheten och förbättrar datakvaliteten.
Låsa upp kraften med data
En av nyckeltillgångarna i moderna bioanalytiska laboratorier är data. Smart datahantering kan spara tid, minska slöseri och ge tillförlitliga svar snabbt. Men i många labb är data utspridda över olika system, inklusive anteckningsböcker och kalkylblad. Detta fragmenterade tillvägagångssätt gör det utmanande att utnyttja data effektivt, vilket leder till missade möjligheter och ineffektivitet.
Med framväxten av anslutna instrument och avancerade analytiska instrument som ELN, LIMS, kan labb nu integrera sina data i en central ryggrad. Denna integration möjliggör strömlinjeformad verksamhet, minskade mänskliga fel och förbättrad datatillgänglighet. Genom att centralisera data kan labb skapa användarvänliga rapporter och arbetsflöden, vilket gör det möjligt för forskare att fatta snabbare och mer välgrundade beslut
Power of ELN, LIMS och LES för bioanalys
Den digitala omvandlingen av bioanalytiska laboratorier underlättas avsevärt genom användningen av Laboratory Information Management Systems (LIMS), Electronic Lab Notebooks (ELN) och Laboratory Execution Systems (LES). Dessa system spelar avgörande roller för att effektivisera verksamheten, förbättra datakvaliteten och förbättra beslutsprocesser.
LIMS (Laboratory Information Management Systems):
LIMS är centrala för implementeringen av en digital strategi i bioanalytiska laboratorier. De tillhandahåller ett strukturerat ramverk för att hantera exempelinformation under hela dess livscykel. Genom att spåra provdetaljer från inloggning till disposition säkerställer LIMS att data fångas in korrekt och konsekvent. Detta centraliserade tillvägagångssätt för datahantering förbättrar dataintegriteten och tillgängligheten, vilket gör det möjligt för forskare att fatta välgrundade beslut mer effektivt.
LIMS spelar en nyckelroll för att integrera data från olika källor, såsom instrument, analyser och experiment. Genom att tillhandahålla en enhetlig plattform för datalagring och hantering gör LIMS det möjligt för labb att effektivisera verksamheten och minska manuella fel. Denna integration underlättar också efterlevnaden av regulatoriska krav, eftersom data enkelt kan granskas och spåras tillbaka till källan.
Sammantaget bidrar LIMS avsevärt till effektiviteten och effektiviteten hos bioanalytiska laboratorier, vilket gör det möjligt för dem att utnyttja data mer effektivt och fatta välgrundade beslut.
ELN (Electronic Lab Notebooks):
ELN är ett annat viktigt verktyg i den digitala omvandlingen av bioanalytiska laboratorier. De tillhandahåller en digital plattform för inspelning och hantering av experimentella data, och ersätter traditionella anteckningsböcker för labb. ELN erbjuder flera fördelar jämfört med pappersanteckningsböcker, inklusive möjligheten att standardisera arbetsflöden, automatisera datainmatning och underlätta samarbete mellan forskare.
En av de viktigaste fördelarna med ELN är deras förmåga att standardisera experimentella arbetsflöden. Genom att tillhandahålla mallar för att registrera experimentella detaljer säkerställer ELN:er att data fångas in konsekvent och korrekt. Denna standardisering förbättrar inte bara datakvaliteten utan gör det också lättare att söka och analysera data.
ELN underlättar också samarbete mellan forskare genom att tillhandahålla en central plattform för att dela och komma åt experimentella data. Denna samarbetsstrategi för datahantering gör det möjligt för forskare att arbeta mer effektivt och effektivt, vilket leder till snabbare beslutsfattande och bättre resultat.
LES (Laboratory Execution Systems):
LES är specialiserade system utformade för att automatisera och genomdriva procedursteg i laboratoriet. I samband med bioanalytiska laboratorier spelar LES en avgörande roll för att säkerställa att experiment utförs konsekvent och enligt standarddriftsprocedurer (SOP).
En av de viktigaste fördelarna med LES är deras förmåga att genomdriva förfarandet under testning. Genom att kapsla in SOPs i mjukvara, säkerställer LES att varje steg i testprocessen registreras och slutförs innan du går vidare till nästa steg. Detta förbättrar inte bara datakvaliteten utan minskar också risken för fel och avvikelser från protokoll.
LES underlättar också realtidsövervakning av experiment, vilket gör det möjligt för forskare att fatta välgrundade beslut baserat på uppdaterad data. Denna feedbackslinga i realtid gör det möjligt för laboratorier att reagera snabbt på förändrade förhållanden och optimera experimentella arbetsflöden för bättre resultat
Förfina bioanalytiska laboratorier: förenande digitala lösningar för effektivitet, kvalitet och innovation
1. Leverera en plattformsbaserad men ändå personlig laboratorieupplevelse
Personalisering av laboratorieteknik kan vara fördelaktigt på kort sikt, men det leder ofta till informationssilos och utmaningar i informationsutbytet. Ett plattformsbaserat tillvägagångssätt, å andra sidan, gör det möjligt för laboratorier att utnyttja integrerade moduler anpassade till standardiserade företagsomfattande FoU-terminologier och -funktioner. Detta tillvägagångssätt, som underlättas av verktyg som LIMS och ELN, möjliggör generering av studiedata av bättre kvalitet och förbättrar samarbetet mellan forskare. Genom att använda harmoniserade tillvägagångssätt på olika platser kan laboratorier uppnå ökad synlighet, spårning av experimentstatus i realtid och förbättrade insikter över experiment.
2. Utnyttja digitala labbverktyg för att låsa upp operativ effektivitet och kostnadsbesparingar
Digitala labbtekniker som LIMS, ELN och kvalitetsledningssystem erbjuder betydande driftseffektivitet och kostnadsbesparingsmöjligheter. Genom att avveckla äldre system, eliminera överflödig datainmatning och bygga granskningsspår kan labb effektivisera arbetsflöden, säkerställa datanoggrannhet och förbättra efterlevnaden av regulatoriska krav. Dessutom minskar dessa tekniker anställdas tid som spenderas på manuella uppgifter och möjliggör realtidsspårning av projektens arbetsbelastning, vilket leder till betydande tidsbesparingar per anställd.
3. Kräv förbättrad datareproducerbarhet och dataanalys för att skapa kommersiellt värde
Datareproducerbarhet är en kritisk utmaning i bioanalytiska laboratorier, vilket leder till slöseri med tid, minskade resurser och lägre vetenskaplig produktion. Digitala plattformar som förbättrar datakvaliteten och ökar statistisk kraft kan hantera denna utmaning. Genom att standardisera data av högre kvalitet kan labb öka reproducerbarheten och förbättra experimentell prestanda. Dessutom kan utnyttjande av dataanalysverktyg hjälpa laboratorier att extrahera ytterligare värde från sina data, vilket påskyndar upptäckten av nya indikationer och molekyler.
Veedas integration av LIMS-, ELN- och LES-lösningar
Veedas bioanalyslösning integrerar Laboratory Information Management System (LIMS), Electronic Laboratory Notebook (ELN) och Laboratory Execution System (LES) funktioner för att optimera vår bioanalytiska labbverksamhet. Detta integrerade tillvägagångssätt för bioanalytiska studier genom att tillhandahålla avancerade verktyg för datahantering, analys och automatisering i ett enda, sammanhängande system.
LIMS centraliserar provspårning och datahantering, vilket säkerställer spårbarhet och överensstämmelse med regulatoriska standarder. Samtidigt digitaliserar ELN experimentella data, förbättrar samarbetet och minskar manuella fel. LES förbättrar våra arbetsflöden ytterligare genom att automatisera processer och genomdriva SOP, vilket säkerställer konsekvens och kvalitet i vår verksamhet. Denna integrering förbättrar våra bioanalytiska procedurer till effektiva, tillförlitliga testmetoder, där vi utnyttjar anslutna instrument och intelligenta datahanteringsfunktioner för att konsekvent förbättra våra levererade resultat.
Referensartiklar:
https://www.technologynetworks.com/informatics/articles/eln-lims-cds-les-whats-the-difference-313834
https://www.labware.com/blog/streamlining-bioanalytical-testing-with-a-unified-lims-and-eln-solution