数据完整性的重要性
科学界见证了临床试验数据完整性历史上一些最严重的悲剧。 从 2015 年至今,《美国医学会杂志》(JAMA) 和 JAMA 网络期刊已发布至少 18 份通知,表达对数据错误和/或数据伪造的担忧。
1 例如,日本麻醉师协会 (JSA) 于 2012 年审查了日本麻醉师和研究人员进行的治疗术后恶心和呕吐的试验,发现了令人震惊的启示。
从试验中获得的数据要么完全是捏造的,要么是欺诈性的,麻醉师发表的大约 210 篇论文存在伪造数据。
2 数据完整性缺陷造成了重大收入损失,直接成本估计接近 525,000 美元,间接成本约为 1.3 万美元。3
这种科学不端行为敲响了警钟,要求加强监管药物开发和药物使用的法规和法律。
科学家们承认,为了保护人类受试者,每个阶段都需要数据完整性,从 临床前开发 药物警戒。
什么是数据完整性?
数据完整性是指从数据创建、归档、扫描、保留和销毁的整个生命周期中完整、准确、一致和可靠的纸质或电子数据。
4 更新后的国际协调委员会良好临床实践指南 (ICH GCP E6[R2]) 重申了数据完整性的必要性以及在整个研究过程中监测临床数据的重要性。
美国食品和药物管理局 (FDA) 使用 ALCOA 缩写来定义对数据完整性的期望。4
数据合规性问题
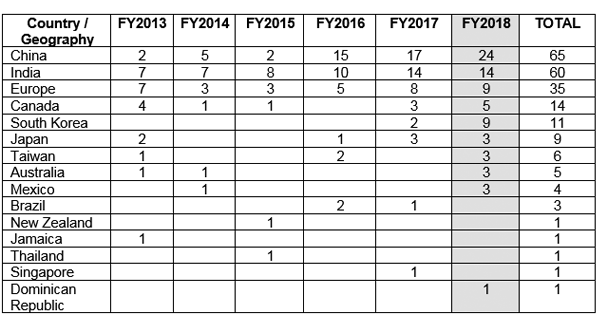
FDA 以数据完整性方面的合规问题为由,向美国 (US) 以外的多个国家发出了良好生产规范 (GMP) 警告信。 图 1 显示中国收到的 GMP 警告信最多,其次是印度和欧洲。5
图 1 美国境外的 GMP 警告信问题5
数据完整性检查站
可以通过检查以下区域来监控数据完整性:6
- ►源数据验证(SDV)
- ►数据访问与控制
- ►数据收集相关人员的培训
例如调查人员、数据处理人员、分析师、现场工作人员和报告撰写者
- ►数据监控: 现场、集中、基于风险的监控
- ►临床试验质量保证单位(QAU):一些申办者设立内部 QAU 或外部 QAU 合同研究组织 (CRO) 以确定试验是否符合标准操作程序 (SOP) 和 FDA 法规。 QAU 还消除了内部偏差的风险。 然而,监管法律并未强制要求建立 QAU。7
- ►临床试验审核
SDV
严格遵守临床试验记录中的良好记录规范 (GDP) 是确保数据完整性的一种方法。 纸质记录以及电子记录和签名均应遵循 GDP。
同样重要的是需要保留和组织临床试验开始前、试验期间以及试验完成或终止后所需的基本文件。
保存在申办者地点和研究者地点的重要文件集合称为临床试验主文件 (TMF)。 TMF 在促进试验实施和管理方面发挥着重要作用,从而保证临床试验各个阶段的数据完整性和 GCP 合规性。 TMF 是在审核或检查期间审查的文件。8
许多制药公司现在正在转向电子 TMF (e-TMF),以便更轻松地管理涉及众多部门或 CRO 的大型复杂临床试验。
数据访问和控制
处理临床试验数据时必须谨慎。 在临床试验的所有阶段,包括中期数据结果,都应保持数据的保密性。
9 篡改数据的能力,例如更改、删除或伪造数据,应通过明确划分的角色来限制。 这还可以防止类似角色之间可能妨碍数据完整性的潜在利益冲突。4
美国国立卫生研究院 (NIH) 规定,只有数据和安全监测委员会 (DSMB) 的投票成员才有权查看中期分析结果,除非情况需要共享数据,例如在严重不利的情况下事件。
9此外,DMC 成员不应存在任何影响结果数据的利益冲突。 FDA 还建议使用“独立统计学家”模型来分析独立于主要研究者和试验申办者的中期数据,并向 DMC 报告公正的结果。10
数据监测
有必要设立独立的数据监测委员会(DMC),优先考虑入组受试者的安全和利益,审查数据的真实性以及临床试验的进行。9
现场监控: 执行此操作是为了追踪源数据和输入数据之间的任何差异。 查看现场工作人员是否熟悉研究文件以及工作人员是否表现出以道德和负责任的方式进行试验的责任也特别有用。11
基于风险的集中方法: ICH GCP E6(R2) 强调需要进行集中监测,以减少临床监测员的试验访问次数,并允许统计学家或其他数据管理人员远程发现可靠和不可靠的数据。4,11
基于风险的监控: 申办公司需要制定健全的风险管理计划,通过监督试验实施和监测试验地点的数据质量来预防或减轻对人类受试者的任何风险。11
数据完整性审核12
- 特定的审计会查找以前未被注意到的任何数据或元数据,例如已删除或未经检查、误用、孤立或重新处理的数据。
- 整个数据生命周期应受到参与试验的所有部门的审查,例如但不限于数据管理、安全、质量风险管理以及统计人员在数据管理和数据访问控制方面的合规问题。4,8
- 为了快速获得结果或数据而进行不必要的激励 高风险 II 期试验 应严密监控不法行为。
- 应重视原始数据,而不是总结报告,并且应针对任何合规问题回溯结果。
结论
为了避免巨大的财务影响和业务损失,申办公司和 CRO 应充分重视维护临床研究每一步的数据完整性,确保其完整性、准确性和一致性。
来源
1. Bauchner H、Fontanarosa Phil B、Flanagin A 等。 科学不端行为和医学期刊。 2018;320(19):1985-1987 https://jamanetwork.com/journals/jama/fullarticle/2708590
2. George SL 和 Buyse M。临床试验中的数据欺诈。 临床研究(伦敦)。 2015; 5(2):161-173。
3. Michalek AM、Hutson AD、Wicher CP 等。 研究不端行为的成本和未被充分认识的后果:案例研究。 PLoS Med. 2018;7(8):e1000318. https://doi.org/10.1371/journal.pmed.1000318
4. Rutherford M. ICH E6(R2) 和数据完整性:四个关键原则。 临床研究员。 2018 April;32(4):doi:10.14524/CR-18-4021. https://acrpnet.org/2018/04/17/ich-e6r2-data-integrity-four-key-principles/
5. https://www.pharmaceuticalonline.com/doc/an-analysis-of-fda-fy-drug-gmp-warning-letters-0003 访问日期:26 年 2019 月 XNUMX 日
6. Moody LE 和 McMillan S. 在随机临床试验中保持数据完整性。 努尔雷斯. 2002 Mar-Apr;51(2):129-33. https://www.ncbi.nlm.nih.gov/pubmed/11984384
7. http://firstclinical.com/fda-gcp/?show=MonitoringvAuditing&search=compliance&type=&page=1 访问日期:26 年 2019 月 XNUMX 日
8. https://www.ema.europa.eu/en/documents/scientific-guideline/draft-guideline-good-clinical-practice-compliance-relation-trial-master-file-paper/electronic-content-management-archiving-audit-inspection-clinical-trials_en.pdf 访问日期:26 年 2019 月 XNUMX 日
9. 弗莱明 TR、沙普尔斯 K、麦考尔 J 等。 维护中期数据的机密性,以提高试验的完整性和可信度。 临床试验. 2008;5(2):157-67. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2703711/
10.艾伦伯格党卫军。 保护临床试验参与者并保护数据完整性:我们是否应对挑战? PLoS Med。 2012 年 9 月;6(1001234):eXNUMX。
11. https://www.thefdagroup.com/thefdgroup-blog/conducting-data-integrity-audits-a-quick-guide 26 年 2019 月 XNUMX 日访问。
免责声明:
本文中包含的信息仅旨在为读者个人使用感兴趣的问题提供一般指导,读者对其使用承担全部责任。 因此,提供本文信息的前提是作者和出版商在此不提供专业建议或服务。 因此,它不应替代与有能力的顾问的咨询。 在做出任何决定或采取任何行动之前,读者应始终咨询与相关文章发布相关的专业顾问。
虽然我们已尽一切努力确保本文中包含的信息是从可靠来源获得的,但 Veeda Clinical Research 对任何错误或遗漏或使用此信息所获得的结果不承担任何责任。
本文中的所有信息均“按原样”提供,不保证完整性、准确性、及时性或使用此信息所获得的结果,也不提供任何形式的明示或暗示的保证,包括但不限于性能、适销性和特定用途适用性的保证。
本文中的任何内容均不得在任何程度上替代读者的独立调查以及合理的技术和商业判断。 在任何情况下,Veeda Clinical Research 或其合作伙伴、员工或代理人均不对读者或任何其他人依据本文信息做出的任何决定或采取的行动或任何间接、特殊或类似损害承担责任,即使被告知发生此类损害的可能性。
未经出版商事先书面许可,不得复制本出版物的任何部分、将其存储在检索系统中或以任何形式或任何方式(机械、电子、复印、录音或其他方式)传播。
如需信息,请联系我们:
Veeda 临床研究私人有限公司
Vedant Complex,YMCA 俱乐部旁边,SG 高速公路,
维贾尔普尔,艾哈迈达巴德 – 380 051,
印度古吉拉特邦。
Phone: +91-79-3001-3000
传真: +91-79-3001-3010
电子邮箱: info@veedacr.com