약력학 바이오마커 정량화: 새로운 화학물질 개발의 약물 영향 및 생체분석
2024 년 1 월 11 일

과학계는 임상시험 데이터 무결성 역사상 최악의 비극을 목격해 왔습니다. 2015년부터 현재까지 미국의학협회저널(JAMA)과 JAMA 네트워크 저널은 데이터 오류 및/또는 데이터 위조에 대한 우려를 언급하는 공지를 최소 18건 게재했습니다.
1 예를 들어, 수술 후 메스꺼움과 구토를 치료하기 위해 일본 마취과 의사와 연구원이 수행한 실험은 2012년 일본 마취과 학회(JSA)에서 검토되어 놀라운 사실이 밝혀졌습니다.
실험에서 얻은 데이터는 완전히 조작되었거나 사기였으며, 마취과 의사가 발표한 약 210개의 논문에는 데이터가 위조되었습니다.
2 데이터 무결성의 붕괴로 인해 상당한 수익 손실이 발생했으며, 직접 비용은 약 525,000달러에 달하는 것으로 추산되고 간접 비용은 약 1.3만 달러에 달합니다.3
이러한 과학적 위법 행위는 약물 개발 및 약물 사용을 모니터링하기 위한 규정과 법률을 강화하라는 경각심을 불러일으키는 역할을 했습니다.
과학자들은 인간 피험자를 보호하기 위해 모든 단계에서 데이터 무결성이 필요하다는 점을 인정했습니다. 전임상 개발 약물 감시에.
데이터 무결성은 데이터 생성, 보관, 검색, 보존 및 파기 시점부터 수명주기 전반에 걸쳐 완전하고 정확하며 일관되고 신뢰할 수 있는 종이 기반 또는 전자 데이터로 정의됩니다.
4 업데이트된 임상시험관리기준 국제조화위원회(ICH GCP E6[R2])에서는 데이터 무결성의 필요성과 연구 전반에 걸쳐 임상 데이터 모니터링의 중요성을 반복적으로 강조하고 있습니다.
미국 식품의약국(FDA)은 ALCOA 약어를 사용하여 데이터 무결성과 관련된 기대치를 정의합니다.4
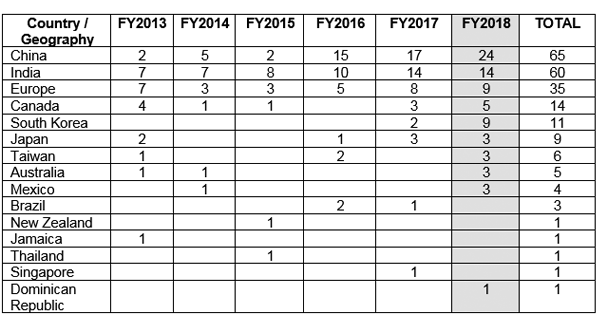
FDA는 데이터 무결성에 대한 규정 준수 문제를 언급하면서 미국(US) 이외의 여러 국가에 우수제조관리기준(GMP) 경고 서한을 발행했습니다. 그림 1은 중국이 최대 GMP 경고 서한을 받았으며 그 뒤를 인도와 유럽이 따른다는 것을 보여줍니다.5
그림 1 미국 외 지역의 GMP 경고문 문제5
다음 영역을 검사하여 데이터 무결성을 모니터링할 수 있습니다.6
SDV
임상 시험 기록에서 GDP(우수 문서 작성 기준)를 엄격하게 준수하는 것은 데이터 무결성을 보장하는 방법입니다. 종이 기록뿐만 아니라 전자 기록 및 서명에 대해서도 GDP를 따라야 합니다.
마찬가지로 임상시험 시작 전, 시험 중, 시험 완료 또는 종료 후에 필요한 필수 문서를 보관하고 정리하는 것도 중요합니다.
의뢰자 사이트와 조사자 사이트에 보관되는 필수 문서 모음을 임상시험 마스터 파일(TMF)이라고 합니다. TMF는 임상시험 수행 및 관리를 촉진하는 데 중요한 역할을 하여 임상시험의 모든 단계에서 데이터 무결성과 GCP 준수를 가능하게 합니다. TMF는 감사 또는 검사 중에 검토되는 문서입니다.8
많은 제약회사는 이제 수많은 부서나 CRO가 참여하는 대규모의 복잡한 임상 시험을 보다 쉽게 관리하기 위해 전자 TMF(e-TMF)로 전환하고 있습니다.
데이터 접근 및 제어
임상시험 데이터를 다룰 때에는 주의를 기울여야 합니다. 데이터의 기밀성은 중간 데이터 결과를 포함하여 임상시험의 모든 단계에서 유지되어야 합니다.
9 데이터를 변경, 삭제, 위조하는 등 데이터를 변조하는 행위는 역할을 명확하게 구분하여 제한해야 합니다. 이는 또한 데이터 무결성을 저해할 수 있는 유사한 역할 간의 잠재적인 이해 상충을 방지합니다.4
국립 보건원(NIH)은 심각한 부작용의 경우와 같이 상황에 따라 데이터를 공유해야 하는 경우를 제외하고 데이터 안전 모니터링 위원회(DSMB)의 투표권 있는 구성원만이 중간 분석 결과를 볼 수 있도록 허용되어야 한다고 명시합니다. 이벤트.
9또한 DMC 구성원은 결과 데이터에 영향을 미칠 수 있는 이해 상충이 없어야 합니다. FDA는 또한 주 연구자 및 임상시험 후원자로부터 독립적인 중간 데이터를 분석하고 편견 없는 결과를 DMC에 보고하기 위해 "독립 통계학자" 모델의 사용을 권장했습니다.10
데이터 모니터링
등록된 피험자의 안전과 이익을 우선시하고 데이터의 진위 여부와 임상시험 수행을 면밀히 조사하는 독립적인 데이터 모니터링 위원회(DMC)를 설립하는 것이 필요합니다.9
현장 모니터링: 원본 데이터와 입력된 데이터 간의 불일치를 추적하기 위해 수행됩니다. 또한 현장 직원이 연구 문서에 대해 잘 알고 있는지, 직원이 임상시험을 윤리적이고 책임감 있게 수행할 책임을 입증했는지 확인하는 것도 특히 유용합니다.11
중앙 집중식 위험 기반 접근 방식: ICH GCP E6(R2)는 임상 모니터의 시험 방문 횟수를 줄이고 통계학자 또는 기타 데이터 관리 직원이 신뢰할 수 있는 데이터와 신뢰할 수 없는 데이터를 원격으로 찾아낼 수 있도록 중앙 집중식 모니터링의 필요성을 강조합니다.4,11
위험 기반 모니터링: 스폰서 회사는 임상 시험 수행을 감독하고 시험 현장 전체의 데이터 품질을 모니터링하여 인간 피험자에 대한 위험을 예방하거나 완화하기 위한 강력한 위험 관리 계획을 개발해야 합니다.11
데이터 무결성 감사12
막대한 재정적 영향과 비즈니스 손실을 방지하려면 후원 회사와 CRO는 완전성, 정확성 및 일관성을 위해 임상 연구의 모든 단계에서 데이터 무결성을 유지하는 데 충분한 역점을 두어야 합니다.
지우면 좋을거같음 . SM
1. Bauchner H, Fontanarosa Phil B, Flanagin A 외. 과학적 부정행위 및 의학 저널. 2018;320(19):1985-1987 https://jamanetwork.com/journals/jama/fullarticle/2708590
2. George SL 및 Buyse M. 임상 시험에서의 데이터 사기. Clin Investig (런드). 2015; 5 (2) : 161-173.
3. Michalek AM, Hutson AD, Wicher CP 외. 연구 부정행위의 비용과 과소평가된 결과: 사례 연구. PLoS Med. 2018;7(8):e1000318. https://doi.org/10.1371/journal.pmed.1000318
4. Rutherford M. ICH E6(R2) 및 데이터 무결성: XNUMX가지 핵심 원칙. 임상연구원. 2018 April;32(4):doi:10.14524/CR-18-4021. https://acrpnet.org/2018/04/17/ich-e6r2-data-integrity-four-key-principles/
5. https://www.pharmaceuticalonline.com/doc/an-analysis-of-fda-fy-drug-gmp-warning-letters-0003 26년 2019월 XNUMX일에 액세스함
6. Moody LE 및 McMillan S. 무작위 임상 시험에서 데이터 무결성을 유지합니다. 누르 해상도. 2002 Mar-Apr;51(2):129-33. https://www.ncbi.nlm.nih.gov/pubmed/11984384
7. http://firstclinical.com/fda-gcp/?show=MonitoringvAuditing&search=compliance&type=&page=1 26년 2019월 XNUMX일에 액세스함
8. https://www.ema.europa.eu/en/documents/scientific-guideline/draft-guideline-good-clinical-practice-compliance-relation-trial-master-file-paper/electronic-content-management-archiving-audit-inspection-clinical-trials_en.pdf 26년 2019월 XNUMX일에 액세스함
9. 플레밍 TR, 샤플스 K, 맥콜 J 외. 임상시험의 무결성과 신뢰성을 높이기 위해 중간 데이터의 기밀성을 유지합니다. 클린 트라이얼. 2008;5(2):157-67. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2703711/
10. 엘렌버그 SS. 임상 시험 참가자 보호 및 데이터 무결성 보호: 우리는 과제를 해결하고 있습니까? PLoS Med. 2012년 9월;6(1001234):eXNUMX.
11. https://www.thefdagroup.com/thefdgroup-blog/conducting-data-integrity-audits-a-quick-guide 26년 2019월 XNUMX일에 확인함.
이 기사에 포함된 정보는 독자의 개인적인 사용에 관한 일반적인 지침을 제공하기 위한 것이며, 독자는 해당 정보의 사용에 대한 전적인 책임을 집니다. 따라서 이 기사에 대한 정보는 저자와 출판사가 전문적인 조언이나 서비스를 제공하는 데 관여하지 않는다는 점을 이해하고 제공됩니다. 따라서, 유능한 조언자와의 상담을 대신하여 이용되어서는 안 됩니다. 어떤 결정을 내리거나 어떤 조치를 취하기 전에 독자는 항상 관련 기사 게시와 관련된 전문 조언자와 상담해야 합니다.
이 기사에 포함된 정보가 신뢰할 수 있는 출처에서 얻어졌는지 확인하기 위해 모든 노력을 기울였으나 Veeda Clinical Research는 오류나 누락 또는 이 정보의 사용으로 얻은 결과에 대해 책임을 지지 않습니다.
이 문서의 모든 정보는 완전성, 정확성, 적시성 또는 이 정보의 사용으로 얻은 결과를 보장하지 않고 "있는 그대로" 제공되며, 이를 포함하되 이에 국한되지 않는 모든 종류의 명시적 또는 묵시적 보증 없이 제공됩니다. 성능, 상품성, 특정 목적에의 적합성을 보증합니다.
본 문서의 어떠한 내용도 독립적인 조사와 독자의 건전한 기술적, 사업적 판단을 대체할 수 없습니다. 어떤 경우에도 Veeda Clinical Research, 그 파트너, 직원 또는 대리인은 이 문서의 정보에 따라 내려진 결정이나 조치에 대해 또는 결과적, 특별 또는 유사한 손해에 대해 독자나 다른 사람에게 책임을 지지 않습니다. , 그러한 손해의 가능성을 통보받은 경우에도 마찬가지입니다.
본 발행물의 어떠한 부분도 발행자의 사전 서면 승인 없이는 복제되거나 검색 시스템에 저장되거나 기계적, 전자적, 사진 복사, 녹음 등 어떠한 형태나 수단으로도 전송될 수 없습니다.
자세한 내용은 다음 주소로 문의하세요.
Veeda 임상 연구 개인 제한
Vedant Complex, YMCA 클럽 옆, SG 고속도로,
베잘푸르, 아마다바드 – 380 051,
구자라트 인도.
전화 : + 91-79-3001-3000
팩스 : + 91-79-3001-3010
이메일 : info@veedacr.com
