Quantificazione dei biomarcatori farmacodinamici: impatto dei farmaci e bioanalisi nello sviluppo di nuove entità chimiche
Gennaio 11, 2024
Casa > Veeda Approfondimenti > Integrità dei dati nella ricerca clinica

La comunità scientifica è stata testimone di alcune delle peggiori tragedie nella storia dell’integrità dei dati degli studi clinici. Dall'anno 2015 ad oggi, le riviste The Journal of the American Medical Association (JAMA) e JAMA Network hanno pubblicato almeno 18 avvisi citando preoccupazione per errori e/o falsificazione dei dati.
1 Ad esempio, gli studi condotti da un anestesista e ricercatore giapponese per il trattamento della nausea e del vomito postoperatori sono stati esaminati dalla Società giapponese di anestesisti (JSA) nel 2012 per trovare rivelazioni sorprendenti.
I dati ottenuti dagli studi erano totalmente falsificati o fraudolenti e circa 210 articoli pubblicati dall'anestesista avevano dati falsificati.
2 Le carenze nell'integrità dei dati hanno causato una significativa perdita di ricavi, con costi diretti stimati intorno ai 525,000 dollari USA e costi indiretti pari a circa 1.3 milioni di dollari USA.3
Tale cattiva condotta scientifica è servita da campanello d’allarme per inasprire i regolamenti e le leggi per monitorare lo sviluppo e l’uso dei farmaci.
Gli scienziati hanno riconosciuto la necessità dell'integrità dei dati in ogni fase per salvaguardare i soggetti umani, a partire da sviluppo preclinico alla farmacovigilanza.
L'integrità dei dati è definita come dati cartacei o elettronici che sono completi, accurati, coerenti e affidabili durante tutto il loro ciclo di vita dal momento della creazione, archiviazione, scansione, conservazione e distruzione dei dati.
4 Le linee guida aggiornate del Consiglio internazionale per l'armonizzazione per la buona pratica clinica (ICH GCP E6[R2]) ribadiscono la necessità di integrità dei dati e l'importanza del monitoraggio dei dati clinici durante lo studio.
La Food and Drug Administration (FDA) degli Stati Uniti utilizza l'acronimo ALCOA per definire le aspettative rispetto all'integrità dei dati.4
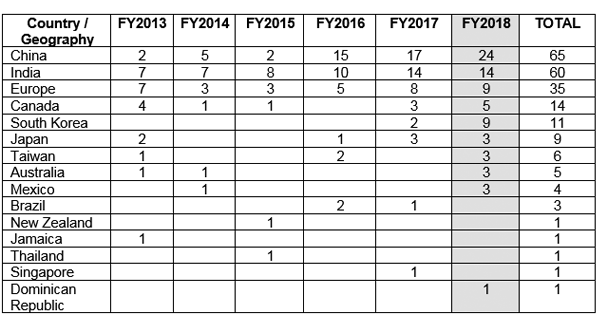
La FDA ha emesso lettere di avvertimento sulle buone pratiche di fabbricazione (GMP) a vari paesi al di fuori degli Stati Uniti, citando problemi di conformità sull'integrità dei dati. La Figura 1 mostra che la Cina ha ricevuto il maggior numero di lettere di avvertimento GMP, seguita da India ed Europa.5
Figura 1 Emissione di lettere di avvertimento GMP al di fuori degli Stati Uniti5
L’integrità dei dati può essere monitorata mantenendo un controllo sulle seguenti aree:6
SDV
La rigorosa aderenza alle buone pratiche di documentazione (GDP) nei registri degli studi clinici è un modo per garantire l’integrità dei dati. Il PIL dovrebbe essere seguito sia per i documenti cartacei che per quelli elettronici e le firme.
Altrettanto importante è la necessità di conservare e organizzare i documenti essenziali richiesti prima dell'inizio di una sperimentazione clinica, durante la sperimentazione e dopo il completamento o la conclusione di una sperimentazione.
La raccolta di documenti essenziali conservata presso la sede dello sponsor e quella dello sperimentatore è denominata master file della sperimentazione clinica (TMF). TMF svolge un ruolo importante nel facilitare la conduzione e la gestione della sperimentazione, consentendo così l'integrità dei dati e la conformità alle GCP in tutte le fasi della sperimentazione clinica. Il TMF è il documento che viene rivisto durante un audit o un'ispezione.8
Molte aziende farmaceutiche si stanno ora spostando verso il TMF elettronico (e-TMF) per una gestione più semplice di studi clinici ampi e complessi che coinvolgono numerosi dipartimenti o CRO.
Accesso e controllo dei dati
È necessario prestare attenzione durante la gestione dei dati provenienti dagli studi clinici. La riservatezza dei dati dovrebbe essere mantenuta durante tutte le fasi di una sperimentazione clinica, compresi i risultati dei dati provvisori.
9 La possibilità di manomettere i dati, ad esempio modificandoli, cancellandoli o falsificandoli, dovrebbe essere limitata delimitando chiaramente i ruoli. Ciò impedisce inoltre potenziali conflitti di interessi tra ruoli simili che potrebbero ostacolare l'integrità dei dati.4
Il National Institute of Health (NIH) afferma che solo i membri votanti del Data and Safety Monitoring Board (DSMB) dovrebbero essere autorizzati a prendere visione dei risultati delle analisi provvisorie, a meno che le circostanze non rendano necessario condividere i dati, come nel caso di gravi eventi avversi. eventi.
9Inoltre, i membri del DMC non dovrebbero avere alcun conflitto di interessi che possa influenzare i dati sui risultati. La FDA ha inoltre raccomandato l'uso di un modello di "statistico indipendente" per analizzare i dati provvisori, che sia indipendente dal ricercatore principale e dallo sponsor dello studio e riporti risultati imparziali al DMC.10
Data Monitoring
È necessario istituire un comitato indipendente per il monitoraggio dei dati (DMC) che dia priorità alla sicurezza e agli interessi dei soggetti arruolati e controlli attentamente l’autenticità dei dati e la conduzione della sperimentazione clinica.9
Monitoraggio in loco: viene effettuato per risalire ad eventuali discrepanze tra i dati di origine ed i dati inseriti. È inoltre particolarmente utile verificare se il personale del sito ha familiarità con il documento dello studio e se ha dimostrato la responsabilità di condurre la sperimentazione in modo etico e responsabile.11
Approccio centralizzato basato sul rischio: ICH GCP E6(R2) sottolinea la necessità di un monitoraggio centralizzato per ridurre il numero di visite di prova da parte del monitor clinico e per consentire l'individuazione remota di dati affidabili e inaffidabili da parte di statistici o altro personale addetto alla gestione dei dati.4,11
Monitoraggio basato sul rischio: L'azienda sponsor è tenuta a sviluppare un solido piano di gestione del rischio per prevenire o mitigare qualsiasi rischio per i soggetti umani supervisionando la condotta della sperimentazione e monitorando la qualità dei dati nei siti di sperimentazione.11
Verifiche sull'integrità dei dati12
Per evitare enormi ripercussioni finanziarie e perdite di affari, le aziende sponsor e le CRO dovrebbero porre sufficiente enfasi sul mantenimento dell'integrità dei dati in ogni fase dello studio clinico per la sua completezza, accuratezza e coerenza.
fonti
1. Bauchner H, Fontanarosa Phil B, Flanagin A et al. Cattiva condotta scientifica e riviste mediche. 2018;320(19):1985-1987 https://jamanetwork.com/journals/jama/fullarticle/2708590
2. George SL e Buyse M. Frode di dati negli studi clinici. Clin Investig (Londra). 2015; 5 (2): 161-173.
3. Michalek AM, Hutson AD, Wicher CP et al. I costi e le conseguenze sottovalutate della cattiva condotta nella ricerca: un caso di studio. PLoS Med. 2018;7(8):e1000318. https://doi.org/10.1371/journal.pmed.1000318
4. Rutherford M. ICH E6(R2) e integrità dei dati: quattro principi chiave. Ricercatore clinico. 2018 April;32(4):doi:10.14524/CR-18-4021. https://acrpnet.org/2018/04/17/ich-e6r2-data-integrity-four-key-principles/
5. https://www.pharmaceuticalonline.com/doc/an-analysis-of-fda-fy-drug-gmp-warning-letters-0003 Accesso effettuato il 26 aprile 2019
6. Moody LE e McMillan S. Mantenimento dell'integrità dei dati negli studi clinici randomizzati. Nur Ris. 2002 Mar-Apr;51(2):129-33. https://www.ncbi.nlm.nih.gov/pubmed/11984384
7. http://firstclinical.com/fda-gcp/?show=MonitoringvAuditing&search=compliance&type=&page=1 Accesso effettuato il 26 aprile 2019
8. https://www.ema.europa.eu/en/documents/scientific-guideline/draft-guideline-good-clinical-practice-compliance-relation-trial-master-file-paper/electronic-content-management-archiving-audit-inspection-clinical-trials_en.pdf Accesso effettuato il 26 aprile 2019
9. Fleming TR, Sharples K, McCall J et al. Mantenere la riservatezza dei dati provvisori per migliorare l’integrità e la credibilità dello studio. Prove cliniche. 2008;5(2):157-67. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2703711/
10. Ellenberg SS. Protezione dei partecipanti alla sperimentazione clinica e protezione dell'integrità dei dati: stiamo affrontando le sfide? PLoS Med. 2012 giugno;9(6):e1001234.
11 https://www.thefdagroup.com/thefdgroup-blog/conducting-data-integrity-audits-a-quick-guide Accesso effettuato il 26 aprile 2019.
Le informazioni contenute in questo articolo hanno lo scopo esclusivo di fornire indicazioni generali su questioni di interesse per l'uso personale del lettore, che si assume la piena responsabilità del loro utilizzo. Di conseguenza, le informazioni su questo articolo sono fornite con la consapevolezza che l'autore(i) e l'editore(i) non sono qui impegnati a fornire consulenza o servizi professionali. Pertanto, non deve essere utilizzato in sostituzione della consultazione di un consulente competente. Prima di prendere qualsiasi decisione o intraprendere qualsiasi azione, il lettore dovrebbe sempre consultare un consulente professionale relativo all'articolo in questione.
Sebbene sia stato fatto ogni sforzo per garantire che le informazioni contenute in questo articolo siano state ottenute da fonti affidabili, Veeda Clinical Research non è responsabile per eventuali errori o omissioni o per i risultati ottenuti dall'uso di queste informazioni.
Tutte le informazioni contenute in questo articolo sono fornite "così come sono", senza alcuna garanzia di completezza, accuratezza, tempestività o dei risultati ottenuti dall'uso di tali informazioni e senza garanzia di alcun tipo, espressa o implicita, incluso, ma non limitato alle garanzie di prestazione, commerciabilità e idoneità per uno scopo particolare.
Nulla di quanto contenuto nel presente documento potrà, in alcun modo, sostituire le indagini indipendenti e il valido giudizio tecnico e commerciale del lettore. In nessun caso Veeda Clinical Research, o i suoi partner, dipendenti o agenti, saranno responsabili nei confronti del lettore o di chiunque altro per qualsiasi decisione presa o azione intrapresa facendo affidamento sulle informazioni contenute in questo articolo o per eventuali danni consequenziali, speciali o simili. , anche se avvisati della possibilità di tali danni.
Nessuna parte di questa pubblicazione può essere riprodotta, archiviata in un sistema di recupero o trasmessa in qualsiasi forma o con qualsiasi mezzo, meccanico, elettronico, fotocopiatrice, registrazione o altro, senza il previo consenso scritto dell'editore.
Per informazioni contattateci a:
Veeda Clinical Research Private Limited
Complesso Vedant, accanto al YMCA Club, SG Highway,
Vejalpur, Ahmedabad – 380 051,
Gujarat India.
Telefono: + 91-79-3001-3000
Fax: + 91-79-3001-3010
E-mail: info@veedacr.com
