Il progresso nelle scienze mediche ha apportato benefici all’umanità in molti modi. Tuttavia, nel corso della conduzione degli studi clinici, sono stati portati alla luce episodi di cattiva condotta scientifica, morale ed etica che hanno scosso la comunità scientifica e il pubblico. Ciò ha portato alla formazione di un’organizzazione formale nel 1979 da parte degli Stati Uniti (USA), vale a dire le “Linee guida etiche internazionali per la ricerca biomedica che coinvolge soggetti umani” per proteggere e salvaguardare gli interessi dei soggetti dello studio. In seguito a ciò, molti paesi hanno redatto le proprie linee guida per le Buone Pratiche Cliniche (GCP). Tuttavia, con il crescente numero di studi clinici condotti in siti di più paesi, era necessario disporre di linee guida uniformi per la conduzione degli studi clinici. Ciò ha dato origine nel 1996 alle linee guida della Conferenza Internazionale sull’Armonizzazione (ICH)-GCP con l’obiettivo di fornire uno standard uniforme che faciliti l’accettazione dei dati degli studi clinici da parte delle autorità regolatorie dei rispettivi paesi. Nel corso del tempo, molti paesi hanno adattato le linee guida ICH-GCP per strutturare le proprie linee guida. Anche l’India ha seguito l’esempio con l’Indian Council of Medical Research (ICMR) che ha introdotto le “Linee guida etiche per la ricerca biomedica su soggetti umani” che vengono continuamente riviste e modificate per garantire che gli studi clinici siano condotti con la massima qualità, dando priorità al benessere dei pazienti. soggetti coinvolti.1
India – Una destinazione globale
L’India sta emergendo come una delle destinazioni preferite per le sperimentazioni cliniche da molte aziende internazionali a causa di diversi fattori:
☉ Contesto normativo favorevole: Processi normativi favorevoli e armonizzati a livello internazionale, come l’approvazione rapida di nuovi farmaci sperimentali, rendono l’ambiente di ricerca clinica indiano più favorevole alla conduzione di sperimentazioni cliniche. Le tendenze del mercato mostrano un tasso di crescita annuale composto (CAGR) di circa il 12% (987 milioni di dollari USA) nel settore indiano degli studi clinici rispetto a 500 milioni di dollari USA nel 2017.1,2,3,4,5
☉ Manodopera qualificata: Disponibilità di operatori sanitari qualificati, specialisti in diverse aree terapeutiche, con una buona conoscenza della lingua inglese e che garantiscano la conformità alle linee guida ICH-GCP.1,2,3
☉ Infrastruttura tecnologica: Tecnologie di livello mondiale nella gestione dei dati, nella tecnologia dell'informazione e nei servizi correlati.1,2,3
☉ Pool di pazienti: Vasta popolazione che è naïve al trattamento e presenta una composizione genetica ed etnica diversificata. Con l’India sempre più urbanizzata e con una maggiore connettività tra le aree urbane e rurali, diventa conveniente reclutare pazienti provenienti da diverse aree geografiche. Inoltre, vi è un’elevata incidenza e prevalenza di malattie acute e croniche dovute a cambiamenti nello stile di vita che portano a malattie come il diabete, il cancro e così via. Tali disturbi legati allo stile di vita aprono la possibilità di condurre più studi clinici in queste aree patologiche.1,2,3,6
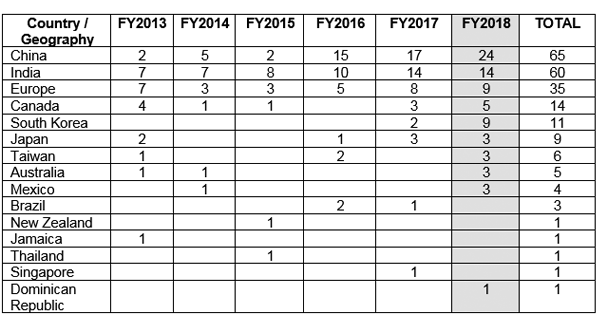
☉ Facilità di reclutamento: In paesi come gli Stati Uniti, circa l’86% degli studi clinici non riesce a reclutare il numero richiesto di soggetti, con un ritardo di quasi un anno. Questo ritardo costa diversi milioni di dollari alla società sponsor. Alcuni dei motivi del ritardo nel reclutamento sono la riluttanza del paziente a partecipare, severi requisiti di sicurezza e ingenti pacchetti di compensi. L’India offre la possibilità di reclutare pazienti con relativa facilità grazie alla maggiore conformità e trasparenza degli studi, in particolare con la recente pubblicazione delle New Drugs and Clinical Trial Rules 2019 che consistono in norme e regolamenti aggiornati per l’approvazione rapida degli studi clinici. Tra i paesi con economie in rapida crescita, è stato notato che l’India ha un tasso di crescita nei siti di reclutamento di circa il 22.6% con il tasso di crescita più elevato registrato in Cina (≈36%).1,2,7,8
☉ Costi competitivi – Il rapporto costo-efficacia è un fattore che spinge molti studi clinici a essere spostati in India. Si stima che il costo per sviluppare un nuovo farmaco sia quasi il 50% inferiore a quello che sarebbe necessario negli Stati Uniti o nell’Unione Europea. 1,2,3
Futuro della ricerca clinica in India
La Central Drugs Standard Control Organization (CDSCO) sta elaborando linee guida specifiche per la ricerca sulle cellule staminali, sui biosimilari e sui dispositivi medici per proteggere i pazienti e incoraggiare la ricerca e lo sviluppo clinici nel paese. Dopo un periodo di pausa nel settore clinico indiano prima del 2015 a causa di preoccupazioni etiche e di qualità, la comunicazione aperta tra i rappresentanti degli sponsor e il team di regolamentazione di CDSCO ha aiutato a riconsiderare ancora una volta l’India come una potenziale destinazione globale per l’arruolamento di una popolazione diversificata in studi clinici che aderire rigorosamente alle linee guida ICH-GCP.6
Disclaimer:
Le informazioni contenute in questo articolo hanno lo scopo esclusivo di fornire indicazioni generali su questioni di interesse per l'uso personale del lettore, che si assume la piena responsabilità del loro utilizzo. Di conseguenza, le informazioni su questo articolo sono fornite con la consapevolezza che l'autore(i) e l'editore(i) non sono qui impegnati a fornire consulenza o servizi professionali. Pertanto, non deve essere utilizzato in sostituzione della consultazione di un consulente competente. Prima di prendere qualsiasi decisione o intraprendere qualsiasi azione, il lettore dovrebbe sempre consultare un consulente professionale relativo all'articolo in questione.
Sebbene sia stato fatto ogni sforzo per garantire che le informazioni contenute in questo articolo siano state ottenute da fonti affidabili, Veeda Clinical Research non è responsabile per eventuali errori o omissioni o per i risultati ottenuti dall'uso di queste informazioni. Tutte le informazioni su questo articolo sono fornite "così come sono", senza alcuna garanzia di completezza, accuratezza, tempestività o dei risultati ottenuti dall'uso di queste informazioni e senza garanzia di alcun tipo, espressa o implicita, incluso, ma non limitato a garanzie di prestazione, commerciabilità e idoneità per uno scopo particolare. Nulla di quanto contenuto nel presente documento sostituirà in alcun modo le indagini indipendenti e il valido giudizio tecnico e commerciale del lettore. In nessun caso Veeda Clinical Research, o i suoi partner, dipendenti o agenti, saranno responsabili nei confronti del lettore o di chiunque altro per qualsiasi decisione presa o azione intrapresa facendo affidamento sulle informazioni contenute in questo articolo o per eventuali danni consequenziali, speciali o simili, anche se informato della possibilità di tali danni. Nessuna parte di questa pubblicazione può essere riprodotta, archiviata in un sistema di recupero o trasmessa in qualsiasi forma o con qualsiasi mezzo, meccanico, elettronico, fotocopiatrice, registrazione o altro senza il previo consenso scritto dell'editore.
Per informazioni contattateci a:
Veeda Clinical Research Private Limited
Complesso Vedant, accanto al YMCA Club, SG Highway,
Vejalpur, Ahmedabad – 380 051,
Gujarat India.
Telefono: + 91-79-3001-3000
Fax: + 91-79-3001-3010
E-mail: info@veedacr.com